Молекулярная масса – это сумма атомных масс, составляющих молекулу вещества. Вычислить молекулярную массу можно, зная химическую формулу вещества и массы его атомов. Для этого необходимо умножить количество каждого атома в формуле на его массу и сложить полученные значения. Такой расчет позволяет точно определить массу вещества и провести различные химические расчеты.
Вопросы для самопроверки
После того, как вы ознакомились с основными методами вычисления молекулярной массы вещества, вы можете проверить свои знания, ответив на следующие вопросы:
- Что такое молекулярная масса вещества?
- Какие методы можно использовать для вычисления молекулярной массы вещества?
- Метод химического анализа;
- Метод масс-спектрометрии;
- Метод физической химии;
- Метод расчета по химической формуле.
- Какой метод является наиболее точным для определения молекулярной массы вещества?
- Какие факторы могут оказывать влияние на точность вычисления молекулярной массы вещества?
- Чистота исследуемого вещества;
- Качество используемых реагентов и оборудования;
- Точность измерений и проведения эксперимента;
- Возможное присутствие в молекуле вещества изотопов разных атомных масс.
- Что такое изотопы?
Молекулярная масса вещества – это суммарная масса всех атомов в молекуле данного вещества. Она выражается в атомных единицах массы (а.е.м.) или в г/моль.
Наиболее точным методом является метод масс-спектрометрии, который позволяет определить массу отдельных атомов и их сочетаний в молекуле вещества.
Изотопы – это атомы одного и того же элемента, но с разными атомными массами. Они содержат одинаковое количество протонов, но разное количество нейтронов в ядре.
Ответьте на эти вопросы, чтобы проверить свои знания в области вычисления молекулярной массы вещества. Правильные ответы помогут вам убедиться, что вы освоили материал. Если вы не знаете ответа на вопрос, рекомендуется повторить соответствующую информацию. Успехов в обучении!
Молекулярная масса элементов
Как вычислить молекулярную массу
Молекулярная масса элемента рассчитывается путем сложения атомных масс его составляющих атомов. Чтобы вычислить молекулярную массу элемента, необходимо узнать количество атомов каждого вида, присутствующих в его молекуле, и умножить их на атомные массы.
Например, для вычисления молекулярной массы воды (H₂O) необходимо сложить атомные массы двух атомов водорода (H) и одного атома кислорода (O), обозначаемых как H₂ и O, соответственно:
- Молекулярная масса водорода (H₂) = 2 * атомная масса водорода (H)
- Молекулярная масса кислорода (O) = 1 * атомная масса кислорода (O)
Молекулярная масса воды (H₂O) = Молекулярная масса водорода (H₂) + Молекулярная масса кислорода (O)
Значение молекулярной массы элементов
Молекулярная масса элемента имеет большое значение для проведения химических расчетов и определения количества вещества. Она используется для определения молей вещества в химических реакциях, расчета массы реагирующих веществ и установления соотношений между веществами.
Также молекулярная масса элемента является важным параметром для определения процента содержания элементов в соединении и составление эмпирической и структурной формулы вещества.
Примеры молекулярной массы элементов
| Элемент | Атомная масса | Молекулярная масса |
|---|---|---|
| Водород (H) | 1.0078 г/моль | 2.0156 г/моль |
| Кислород (O) | 15.999 г/моль | 15.999 г/моль |
| Углерод (C) | 12.011 г/моль | 12.011 г/моль |
Например, молекулярная масса уксусной кислоты (CH₃COOH) определяется как сумма атомных масс углерода (C), водорода (H) и кислорода (O), присутствующих в ее молекуле:

- Молекулярная масса углерода (C) = 1 * атомная масса углерода (C)
- Молекулярная масса водорода (H) = 4 * атомная масса водорода (H)
- Молекулярная масса кислорода (O) = 2 * атомная масса кислорода (O)
Молекулярная масса уксусной кислоты (CH₃COOH) = Молекулярная масса углерода (C) + Молекулярная масса водорода (H) + Молекулярная масса кислорода (O)
Таким образом, зная молекулярную массу элементов, можно эффективно проводить химические расчеты и анализировать состав вещества. Молекулярная масса элементов является важной характеристикой для определения их свойств и взаимодействий с другими веществами.
Зачем нужно знать молекулярную массу?
Определение количества вещества
Зная молекулярную массу вещества, мы можем вычислить количество молекул в определенном объеме. Это может быть полезно, например, при проведении химических реакций, где точное соотношение реагентов играет решающую роль.
Расчет массы вещества
Молекулярная масса также позволяет определить массу вещества. Путем умножения молярной массы на количество молей можно получить массу вещества в граммах. Это полезно, например, при подготовке растворов или рассчете стехиометрических коэффициентов в химических реакциях.
Определение физических свойств вещества
Молекулярная масса может влиять на физические свойства вещества, такие как точка кипения, плотность или температура плавления. Зная молекулярную массу, можно делать предположения о химических и физических свойствах вещества и прогнозировать их поведение при различных условиях.
Идентификация вещества
Молекулярная масса помогает установить идентичность вещества. Сравнение экспериментально определенной молекулярной массы с теоретической позволяет убедиться, что исследуемое вещество соответствует определенному химическому соединению. Это важно в химическом анализе и исследованиях в области химии и фармацевтики.
Как определить молярную массу
Шаг 1: Найти химическую формулу
Первый шаг в определении молярной массы – найти химическую формулу вещества. Химическая формула показывает, из каких элементов состоит молекула вещества и в каком соотношении они находятся. Например, химическая формула воды – H2O, где H обозначает атом водорода, а O – атом кислорода.
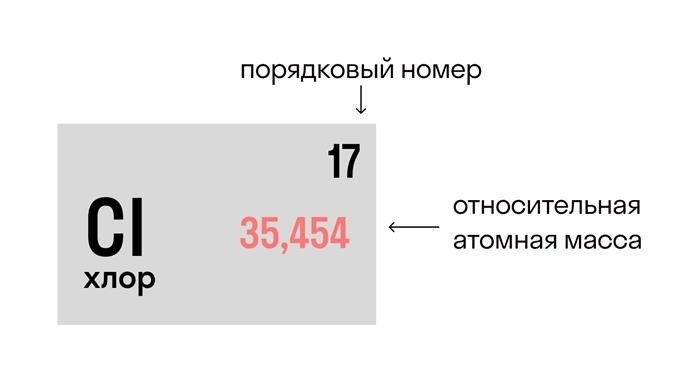
Шаг 2: Найти атомные массы
Далее необходимо найти атомные массы элементов, входящих в молекулу вещества. Атомная масса – это масса одного атома элемента, выраженная в атомных единицах. Такую информацию можно найти в периодической таблице элементов.
Шаг 3: Умножить атомные массы на количество атомов
Каждому элементу в химической формуле соответствует определенное количество атомов. После нахождения атомных масс элементов необходимо эти массы умножить на количество атомов элемента в молекуле вещества. Например, для воды (H2O) молярная масса будет равна величине атомной массы водорода, умноженной на 2, плюс величина атомной массы кислорода.
Пример расчета молярной массы
| Элемент | Атомная масса | Количество атомов | Масса |
|---|---|---|---|
| Водород (H) | 1.008 г/моль | 2 | 2.016 г |
| Кислород (O) | 16.00 г/моль | 1 | 16.00 г |
Итоговая молярная масса воды (H2O) равна 18.016 г/моль.
Таким образом, для определения молярной массы необходимо знать химическую формулу вещества, атомные массы элементов и количество атомов каждого элемента в молекуле. Путем умножения атомных масс на количество атомов и сложения полученных значений можно получить молярную массу вещества.
Молекулярная масса и молярная масса
Молекулярная масса представляет собой сумму атомных масс всех атомов, входящих в состав молекулы. Она вычисляется путем сложения масс всех атомов, которые образуют молекулу. Молекулярная масса измеряется в атомных единицах массы (у). Например, молекулярная масса воды (H₂O) равна сумме масс двух атомов водорода и одного атома кислорода.
Расчет молекулярной массы
Расчет молекулярной массы может быть выполнен с использованием периодической системы элементов и данных о количестве атомов каждого элемента в молекуле. Для этого необходимо:
- Найти элементы, составляющие молекулу;
- Определить атомные массы каждого элемента (указаны в периодической системе элементов);
- Умножить атомные массы на количество атомов каждого элемента в молекуле;
- Сложить все полученные значения, чтобы получить молекулярную массу.
Молярная масса – это масса одного моля вещества, выраженная в граммах. Она равна молекулярной массе, но измеряется в граммах. Молярная масса позволяет определить количество вещества (молей) в данной массе вещества.
Расчет молярной массы
Расчет молярной массы производится следующим образом:
- Расчет молекулярной массы с использованием периодической системы элементов;
- Перевод молекулярной массы в граммы (1 у = 1 г/моль);
- Сравнение массы с одним молем вещества и определение количества молей в данной массе вещества.
Молекулярная масса и молярная масса являются важными химическими понятиями, позволяющими определить массу молекулы и количество вещества. Расчет молекулярной массы требует знания атомных масс элементов, а расчет молярной массы позволяет связать массу вещества с количеством вещества. Оба понятия важны для понимания химических процессов и свойств вещества.

Как определить молекулярную массу элементов и химических соединений?
Для определения молекулярной массы элемента:
- Найдите атомный номер элемента в периодической таблице.
- Найдите атомную массу элемента в периодической таблице.
Молекулярная масса элемента будет равна его атомной массе в аму.
Для определения молекулярной массы химического соединения:
- Запишите химическую формулу соединения.
- Найдите атомные массы всех элементов, входящих в формулу.
- Умножьте атомные массы элементов на их коэффициенты в формуле соединения.
- Сложите полученные произведения. Полученная сумма и будет молекулярной массой соединения.
Молекулярная масса химического соединения выражается в аму.
Некоторые примеры:
| Соединение | Химическая формула | Молекулярная масса (аму) |
|---|---|---|
| Вода | H2O | 18.015 |
| Диоксид углерода | CO2 | 44.01 |
| Аммиак | NH3 | 17.03 |
Знание молекулярной массы элементов и соединений позволяет проводить различные расчеты в химии, такие как определение количества вещества в реакциях, вычисление массы вещества и другие.
Что такое моль?
Используя моль, ученые могут более точно изучать взаимодействия и свойства веществ. Понимание понятия моля может быть полезно при вычислении молекулярной массы вещества.
Связь между молями и атомами
Один моль вещества содержит определенное число частиц (атомов, молекул или ионов), которое называется постоянной Авогадро. Это число составляет примерно 6,022 * 10 23 частиц на одну моль.
Моль является связующим звеном между макроскопическими и микроскопическими размерами вещества. Она позволяет ученым преобразовывать массу вещества в количество атомов и наоборот.
Примеры использования моля
- В химических уравнениях моль используется для определения соотношения между различными веществами. Например, уравнение C6H12O6 + 6O2 → 6CO2 + 6H2O показывает, что для полного сжигания одной молекулы глюкозы требуется 6 молекул кислорода.
- Молярная масса вещества вычисляется путем суммирования атомных масс его составляющих элементов. Например, молярная масса H2O (воды) равна 18 г/моль (2 г за каждый атом водорода и 16 г за атом кислорода).
Моль – это важная единица измерения в химии, которая помогает ученым изучать и понимать молекулярные и атомные свойства вещества. С ее помощью можно вычислять и анализировать количество атомов, молекул и ионов в различных веществах. Понимание понятия моля позволяет ученым создавать новые соединения, анализировать химические реакции и разрабатывать новые материалы.
Относительная плотность одного газа по другому
Относительная плотность одного газа по другому вычисляется на основе их молекулярных масс и соотношениями их плотностей в стандартных условиях. Для вычисления относительной плотности газа А по газу В используется следующая формула:
Относительная плотность А по В = (молекулярная масса А / молекулярная масса В) * (плотность В / плотность А)
Здесь молекулярная масса А и молекулярная масса В представляют собой массу одной молекулы газа A и газа B соответственно, а плотность А и плотность В представляют собой плотность газа A и газа B в стандартных условиях. Стандартные условия обычно определяются как температура 0 °C и давление 1 атмосфера.
Относительная плотность газов позволяет сравнивать их плотности и определять, какой из газов имеет большую или меньшую плотность по сравнению с другими газами. Это полезная информация при изучении физических свойств газов и их взаимодействия с другими веществами.
Итак, относительная плотность одного газа по другому вычисляется с использованием их молекулярных масс и плотностей в стандартных условиях. Это позволяет сравнивать плотности газов и анализировать их физические свойства. Вычисление относительной плотности газов является важным инструментом в химии и физике для изучения свойств вещества.