Относительная молекулярная масса (ОММ) – это средняя масса всех атомов в молекуле в отношении массы одного атома углерода-12. Рассчитать относительную молекулярную массу можно, зная массу каждого атома в молекуле и их количество. Процесс рассчета массы включает в себя использование периодической системы элементов и математических операций. В этой статье мы рассмотрим шаги, необходимые для рассчета относительной молекулярной массы.
Как вычислить абсолютную массу молекулы
Формула для вычисления абсолютной массы молекулы
Абсолютная масса молекулы = (масса первого атома * количество атомов первого элемента) + (масса второго атома * количество атомов второго элемента) + …
Примеры вычисления абсолютной массы молекулы
Пример 1: Для молекулы воды (H2O) необходимо учитывать, что воду составляют 2 атома водорода (H) и 1 атом кислорода (O). Массы атомов водорода и кислорода составляют примерно 1 единицу и 16 единиц соответственно. Следовательно, абсолютная масса молекулы воды будет равна (1 * 2) + (16 * 1) = 18 единиц.
Пример 2: Для молекулы ацетона (C3H6O) необходимо учитывать, что ацетон состоит из 3 атомов углерода (C), 6 атомов водорода (H) и 1 атома кислорода (O). Массы атомов углерода, водорода и кислорода составляют примерно 12 единиц, 1 единицу и 16 единиц соответственно. Следовательно, абсолютная масса молекулы ацетона будет равна (12 * 3) + (1 * 6) + (16 * 1) = 58 единиц.

Вычисление абсолютной массы молекулы осуществляется путем сложения масс всех атомов, которые входят в состав данной молекулы. Зная массы атомов, можно применять формулу для нахождения абсолютной массы. Приведенные примеры помогут понять, как применять эту формулу на практике.
Что мы узнали?
Ознакомившись с темой “Как рассчитать относительную молекулярную массу”, мы узнали много полезной информации, которая поможет нам провести данное вычисление. Вот ключевые моменты, которые стоит отметить:
1. Относительная молекулярная масса
Относительная молекулярная масса (Молярная масса) – это сумма всех атомных масс атомов в молекуле. Она измеряется в атомных единицах массы (ю).
2. Массовое число атома
Массовое число атома – это сумма числа протонов и нейтронов в его ядре. Оно представляет собой целое число и обозначается символом ‘А’.
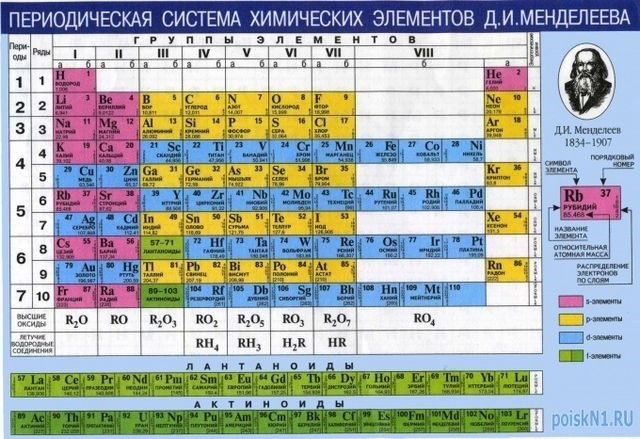
3. Молекулярная формула и относительная молекулярная масса
Молекулярная формула указывает, из каких атомов состоит молекула и как они соединены. Например, молекула воды имеет молекулярную формулу H2O, где H обозначает атом водорода, а O – атом кислорода. Для расчета относительной молекулярной массы нужно сложить массы всех атомов в молекуле.
4. Расчет относительной молекулярной массы
Для расчета относительной молекулярной массы нужно найти массовое число каждого атома в молекуле и сложить их. Массовое число можно найти в периодической системе химических элементов. Затем нужно умножить количество каждого атома на его массовое число и сложить полученные значения.
5. Пример расчета относительной молекулярной массы
Рассмотрим простой пример. Пусть у нас есть молекула воды (H2O). Массовое число водорода (Н) равно 1, массовое число кислорода (О) равно 16. Умножим количество атомов каждого элемента на его массовое число: (2 * 1) + (1 * 16) = 18. Таким образом, относительная молекулярная масса воды равна 18 ю.
И таким образом мы изучили основные понятия и методы расчета относительной молекулярной массы. Это знание позволит нам более глубоко понимать химические процессы и проводить необходимые рассчеты в химических расчетах и экспериментах.

Вычисление массовой доли химического элемента по формуле вещества
Массовая доля химического элемента в веществе выражается математическим отношением массы атомов данного элемента к молекулярной массе вещества в целом. Как правило, массовая доля выражается в процентах и показывает, сколько граммов данного элемента содержится в 100 граммах вещества.
Шаги для вычисления массовой доли химического элемента:
- Найдите молекулярную массу вещества.
- Определите массу атомов химического элемента в молекуле вещества.
- Вычислите массовую долю химического элемента как отношение массы атомов данного элемента к молекулярной массе вещества с учетом единиц измерения – процентов (%).
Давайте рассмотрим пример. Найдем массовую долю кислорода (О) в молекуле воды (Н₂О).
| Элемент | Атомная масса (г/моль) | Количество атомов | Масса атомов (г) |
|---|---|---|---|
| Н | 14,01 | 2 | 28,02 |
| О | 16,00 | 1 | 16,00 |
Молекулярная масса воды (Н₂О) равна 18,02 г/моль.
Массовая доля кислорода в воде:

Массовая доля кислорода = (16,00 г / 18,02 г) * 100% = 88,91%
Таким образом, в молекуле воды массовая доля кислорода составляет 88,91%.
Значение массовой доли химического элемента:
Вычисление массовой доли химического элемента по формуле вещества позволяет определить его количество в составе вещества. Знание массовой доли элемента важно при проведении различных химических реакций, анализе состава вещества и изучении его свойств.
Относительная атомная масса химического элемента
Относительная атомная масса химического элемента является важным параметром, который используется в химических расчетах, таких как рассчеты молекулярной массы соединений и определение стехиометрии реакций. Она также позволяет сравнивать массу атомов различных элементов.
Чтобы вычислить относительную атомную массу химического элемента, необходимо знать пропорции изотопов этого элемента и их относительные массы. Обычно относительная атомная масса указывается в периодической системе элементов и является средним значением для всех изотопов данного элемента.
Следует отметить, что относительная атомная масса может изменяться в зависимости от источника информации, так как пропорции изотопов могут незначительно варьировать в естественных образцах. Тем не менее, она остается хорошей ориентировочной величиной для химических расчетов и сравнения элементов.