Отталкивание и притяжение между молекулами проявляются более ярко в зависимости от их взаимного расположения и энергетического состояния. Когда молекулы находятся близко друг к другу и их энергия взаимодействия достаточно сильна, проявление отталкивания и притяжения становится более заметным. Это условие влияет на различные физические и химические свойства веществ, определяя их поведение в различных окружающих условиях.
Зависимость притяжения от расстояния
Притяжение между молекулами может проявляться в разных условиях и зависит от расстояния между ними.
Существует определенная зависимость между силой притяжения и расстоянием.
Зависимость силы притяжения от расстояния
Сила притяжения между молекулами обратно пропорциональна квадрату расстояния между ними.

Это означает, что при увеличении расстояния между молекулами в два раза, сила притяжения становится четыре раза слабее.
Наоборот, при уменьшении расстояния в два раза сила притяжения увеличивается в четыре раза.
Предельные значения силы притяжения
Существуют два предельных значения, когда сила притяжения между молекулами становится наиболее заметной:
- Когда молекулы находятся на очень малом расстоянии друг от друга, силы притяжения проявляются наиболее интенсивно. Это связано с тесным прилипанием молекул друг к другу.
- Когда молекулы находятся на относительно большом расстоянии друг от друга, силы притяжения также могут проявляться заметно, это обусловлено воздействием дальнодействующих электромагнитных сил.
Примеры проявления силы притяжения
В повседневной жизни можно встретить ряд примеров, когда сила притяжения между молекулами проявляется заметнее при определенном расстоянии:
- Адгезия на поверхностях. Например, капли воды на стекле могут прилипать к поверхности благодаря притяжению между молекулами стекла и молекулами воды.
- Сцепление при клеении. При клеении разных материалов используются клеевые вещества, которые обеспечивают прочное сцепление между поверхностями. Это связано с притяжением молекул клеевого вещества и молекул на поверхностях соединяемых материалов.
Притяжение между молекулами проявляется наиболее заметно при определенных расстояниях. Зависимость силы притяжения от расстояния подчиняется обратной пропорциональности, поэтому при увеличении расстояния между молекулами сила притяжения ослабевает, а при сближении расстояния – усиливается. Знание этой зависимости позволяет объяснить различные физические явления, связанные с притяжением между молекулами и использовать их в практических целях.
Смачиваемость и несмачиваемость: проявление взаимодействия молекул
Как определить смачивание или несмачивание
Для определения смачивания или несмачивания используется контактный угол – угол между поверхностью материала и поверхностью капли жидкости. Когда угол между краем капли и поверхностью равен 0 градусам, это указывает на полное смачивание, когда жидкость равномерно распределяется по поверхности. Когда угол стремится к 180 градусам, это значит, что материал несмачивающий и жидкость собирается в капли.
Факторы, влияющие на смачиваемость и несмачиваемость
Смачивание и несмачивание могут быть влиянием различных факторов, таких как:
- Химический состав поверхности материала;
- Структура поверхности материала;
- Температура и вязкость жидкости;
- Наличие примесей или покрытий на поверхности материала;
- Интерфейсные эффекты между материалом и жидкостью.
Применение смачиваемости и несмачиваемости
Смачивание и несмачивание имеют важное практическое применение в различных областях, таких как:
- Производство и покрытие поверхностей;
- Технология печати и окраски;
- Медицинская диагностика и анализ;
- Биологические исследования и технологии;
- Наука и инженерия материалов.
Смачиваемость и несмачиваемость – это свойства, определяющие взаимодействие между молекулами материала и молекулами жидкости. Они имеют важное значение в различных областях и могут быть изменены с помощью различных факторов. Понимание этих свойств позволяет эффективно использовать материалы и разрабатывать новые технологии.
Взаимное притяжение молекул: условия проявления и силы влияния
Условия проявления взаимного притяжения молекул
Взаимное притяжение молекул может проявляться при определенных условиях:
- Близком расстоянии между молекулами;
- Наличии электрических зарядов;
- Особенностях строения и формы молекул;
- Наличии полярности молекул.
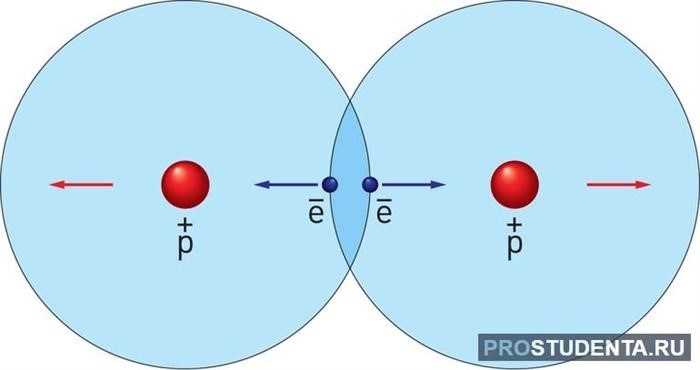
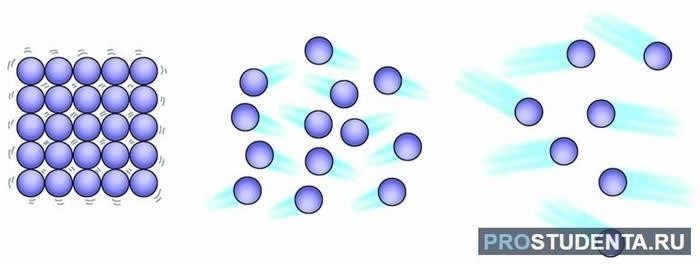
Близкое расстояние между молекулами: Молекулы должны находиться на достаточно близком расстоянии друг от друга, чтобы взаимодействие было заметным. В веществах в газовой фазе, молекулы находятся на больших расстояниях между собой, поэтому взаимное притяжение молекул в газах проявляется слабо. В жидкостях и твердых телах, молекулы располагаются гораздо ближе друг к другу, что способствует более сильному притяжению.
Наличие электрических зарядов: Если молекулы имеют электрические заряды, они притягиваются друг к другу сильнее. Например, положительные и отрицательные ионы, а также полярные молекулы (молекулы с разделенными положительным и отрицательным зарядами) проявляют более сильное взаимное притяжение между собой.
Особенности строения и формы молекул: Форма и строение молекул также влияют на взаимное притяжение. Например, вещества с молекулами линейной или сферической формы могут проявлять сильное притяжение между молекулами.
Наличие полярности молекул: Полярные молекулы имеют разделенные положительные и отрицательные заряды, что способствует их взаимному притяжению. Это происходит из-за разности электронного облака в молекуле, вызванной электроотрицательностью атомов. Взаимное притяжение между полярными молекулами может быть заметным и сильным.
Силы влияния взаимного притяжения молекул
Силы, вызванные взаимным притяжением молекул, могут быть различной силы и проявляться в разных веществах:
- Ван-дер-Ваальсовы силы: слабые силы притяжения между неполярными молекулами, вызванные временным изменением распределения электронов. Эти силы характерны для газов и легких жидкостей.
- Электростатические силы: силы притяжения или отталкивания между заряженными молекулами. Они могут быть как электрическими, так и магнитными.
- Диполь-дипольные силы: силы притяжения между полярными молекулами, вызванные разностью зарядов в молекуле. Они могут быть сильными и влиять на свойства жидкостей и твердых тел.
- Водородные связи: особый вид диполь-дипольных сил, возникающих между атомами водорода и электроотрицательными атомами, такими как кислород, азот или фтор.
- Йонно-дипольные силы: силы притяжения между ионами и полярными молекулами.
Силы взаимного притяжения молекул играют важную роль в объяснении различных химических и физических свойств вещества, включая кипение, конденсацию, плавление, испарение и твердение. Также они влияют на растворимость и вязкость вещества.
Краткое описание межмолекулярного взаимодействия
Притяжение между молекулами проявляется при наличии сил притяжения между их заряженными или поляризованными частями. В результате такого притяжения молекулы могут образовывать сложные структуры, такие как кристаллы или молекулярные ассоциаты. Примерами таких сил притяжения являются взаимодействия водородных связей и Лондоновские дисперсионные силы.
Отталкивание между молекулами проявляется в случае, когда между частицами действуют отталкивающие друг друга силы. Это может происходить из-за взаимодействия зарядов одинакового знака или наличия отталкивающих групп в молекуле. Отталкивающие силы препятствуют сближению молекул и сохранению их структуры.

Ключевыми факторами, определяющими силу притяжения или отталкивания между молекулами, являются электрические свойства молекул, их форма и размеры, а также окружающая среда. В разных условиях молекулярное взаимодействие может проявляться в разной степени.
Изучение межмолекулярного взаимодействия имеет важное значение для различных научных областей, таких как химия, физика и биология. Понимание принципов межмолекулярных взаимодействий позволяет объяснить различные явления и свойства веществ и способствует разработке новых материалов и лекарственных препаратов.
В итоге, межмолекулярное взаимодействие является важным фактором, определяющим поведение вещества и его свойства. Взаимодействие между молекулами может быть как притяжением, так и отталкиванием, и обусловлено различными физическими и химическими факторами.