Вещества – это субстанции, имеющие определенный состав и химические свойства. В химии они делятся на две группы: простые и сложные. Простые вещества состоят из одного вида атомов, например, кислород или азот. Они не могут быть разложены на более простые составляющие. Сложные вещества состоят из двух или более различных элементов, объединенных в определенных пропорциях. Примерами сложных веществ являются сахар или вода.
Основные классы неорганических веществ
Неорганические вещества разделяются на несколько основных классов в зависимости от их химического состава и структуры. Рассмотрим каждый из этих классов подробнее:
Кислоты
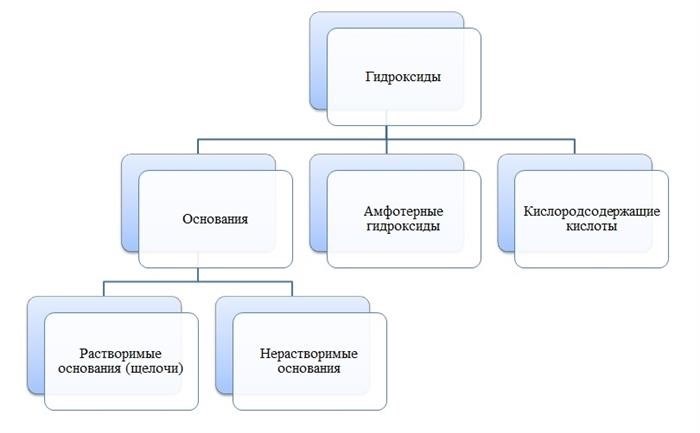
Кислоты представляют собой химические соединения, обладающие кислотными свойствами. Они образуются при соединении водорода с неметаллами или их оксидами. Кислоты проявляют кислотность в растворе, образуя ион водорода (H+). Примерами кислот могут служить соляная кислота, серная кислота и уксусная кислота.
Основания
Основания – это вещества, обладающие щелочными свойствами. Они образуются при соединении металлов с гидроксидом, например, натрия с гидроксидом натрия (NaOH). Основания образуют ионы гидроксида (OH-) в растворе и обладают щелочностью. Примерами оснований могут служить гидроксид натрия, гидроксид калия и гидроксид аммония.

Соли
Соли – это химические соединения, образующиеся при замещении одного или нескольких атомов водорода в кислоте ионами металлов или положительными радикалами. Соли обладают характерными свойствами, зависящими от ионов, из которых они состоят. Например, хлорид натрия (NaCl) – это соль, состоящая из ионов натрия (Na+) и хлорида (Cl-).
Оксиды
Оксиды представляют собой химические соединения, состоящие из атомов кислорода и других элементов. Оксиды могут быть кислотными, основными или нейтральными, в зависимости от взаимодействия с водой и образования кислот или оснований. Примерами оксидов могут служить оксид углерода (CO2), оксид азота (NO2) и оксид кальция (CaO).
Гидриды
Гидриды – это вещества, состоящие из атомов водорода и других элементов. Они могут быть ковалентными или ионными. Гидриды обычно образуются при соединении металлов с водородом. Примерами гидридов могут служить гидрид натрия (NaH), гидрид кальция (CaH2) и гидрид алюминия (AlH3).
Названия кислот и кислотных остатков
Названия кислот
Названия кислот могут быть очень разнообразными, они зависят от состава и химической структуры соединения. Наиболее распространены следующие типы названий:
- Имена, основанные на названии основного элемента. Например, соляная кислота HCl называется хлороводородной кислотой.
- Имена, основанные на названии сложного иона. Например, серная кислота H2SO4 называется сульфатной кислотой.
- Имена, основанные на названии кислотного остатка. Например, угольная кислота H2CO3 называется карбонатной кислотой.
Кислотные остатки
Кислотные остатки представляют собой анионы, образованные после отщепления одного или нескольких атомов водорода из молекулы кислоты. Они являются основными строительными блоками для создания названий кислот и важны для понимания их свойств и реакций.
Ниже представлены примеры некоторых кислотных остатков:
- Ацетат (CH3COO-) – остаток, образованный после отщепления протона из уксусной кислоты. Этот остаток является основным компонентом ацетатных солей.
- Сульфат (SO4 2-) – остаток, образованный после отщепления двух протонов из серной кислоты. Сульфаты широко распространены в природе и обладают разнообразными свойствами.
- Фосфат (PO4 3-) – остаток, образованный после отщепления трех протонов из фосфорной кислоты. Фосфаты играют важную роль в метаболизме и являются основными компонентами ДНК и АТФ.
Названия кислот и кислотных остатков могут быть достаточно сложными и зависят от специфики каждого соединения. Знание этих названий позволяет ученым и химикам классифицировать и изучать кислоты, а также использовать их в различных химических процессах и реакциях.
Что мы узнали?
В этой статье мы узнали много интересного о простых и сложных веществах в химии. Важно отметить, что простые вещества состоят из одного вида атомов, в то время как сложные вещества состоят из различных элементов, соединенных химическими связями.
Мы изучили различные химические элементы и их символы, а также их свойства. Кроме того, мы узнали, как образуются химические соединения путем соединения атомов ионами или ковалентными связями. Также мы рассмотрели различные методы разложения веществ, включая электролиз и термическое разложение.
Более того, мы узнали о различных классификациях химических реакций, таких как синтез, анализ, однозаместительная, двухзаместительная и разложение. Мы рассмотрели примеры каждой из этих реакций и изучили, как они происходят.