Периодический закон – это фундаментальное правило, отражающее регулярные закономерности в химическом строении элементов. Согласно этому закону, свойства элементов меняются периодически с изменением их атомного номера. Основой для систематизации элементов по атомным номерам является периодическая система химических элементов. Она представляет собой таблицу, в которой элементы расположены последовательно по возрастанию атомных номеров и организованы в группы и периоды в соответствии с закономерными изменениями их свойств.
Химический элемент и его свойства
Основные свойства химического элемента:
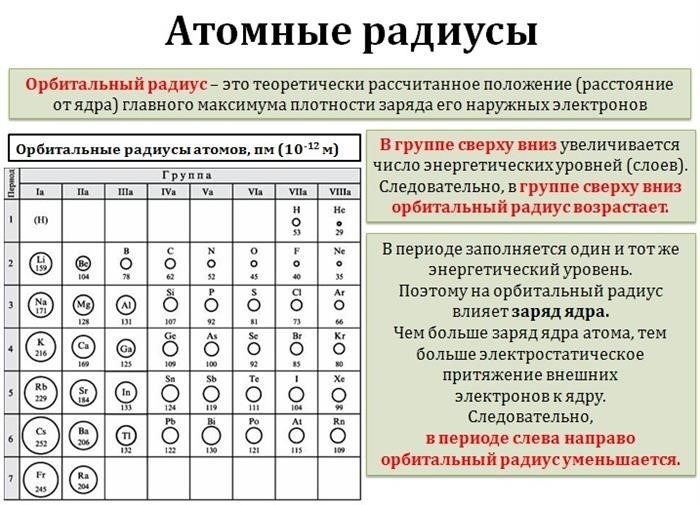
- Атомный радиус: характеризует размер атома. Он изменяется в пределах периода и группы периодической системы.
- Ионизационная энергия: количество энергии, необходимое для отрыва внешнего электрона от атома. Она возрастает с увеличением атомного номера.
- Электроотрицательность: способность атома притягивать электроны к себе. Она изменяется в пределах периода и группы периодической системы.
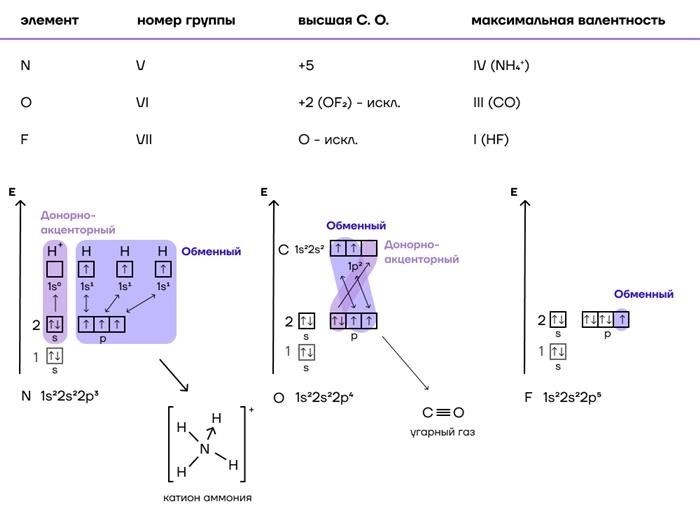
- Валентность: число электронов, которые атом может отдать или получить при образовании химической связи.
Химический элемент и его период и группа
Каждый химический элемент в периодической системе имеет своё место, определяемое его периодом и группой.
| ПЕРИОД | ГРУППА |
|---|---|
| 1 | 1 |
| 2 | 1 |
| 3 | 1 |
| … | … |
Периодичность свойств химических элементов
Свойства химических элементов периодически повторяются в периоде и меняются в пределах группы.
М.В. Ломонов: “Периодический закон является одной из важнейших закономерностей в химии. Он объясняет периодическую изменчивость свойств химических элементов и позволяет классифицировать их в периодической системе.”
Закономерности изменения химических свойств элементов
Химические свойства элементов периодической системы Менделеева обладают определенными закономерностями в зависимости от их положения в таблице. Рассмотрим основные закономерности, определяющие изменение химических свойств элементов.
Валентность элементов
Валентность элемента влияет на его способность образовывать химические соединения и вступать в реакции. Валентность определяется числом валентных электронов во внешней электронной оболочке элемента. Она может быть постоянной для некоторых элементов, например, кислорода всегда имеет валентность -2, алкалийные металлы всегда имеют валентность +1. У других элементов валентность может меняться в зависимости от условий реакции. Например, у железа в целом валентность +2, однако оно может иметь валентность +3 в определенных соединениях.
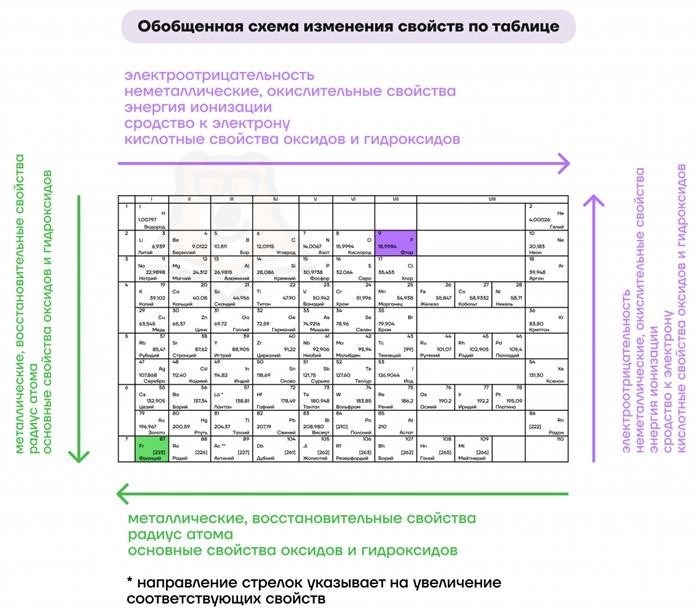
Радиус атомов
Радиус атома определяет размер элемента и его способность вступать в реакции. Общая тенденция заключается в том, что радиус атома увеличивается по мере продвижения от верхнего левого угла таблицы к нижнему правому углу. Это связано с увеличением числа электронов и электронных оболочек в периодах и группах. Однако, существуют некоторые исключения, например, атомы вещества и металлы имеют меньший размер, чем атомы других элементов в их периодах.
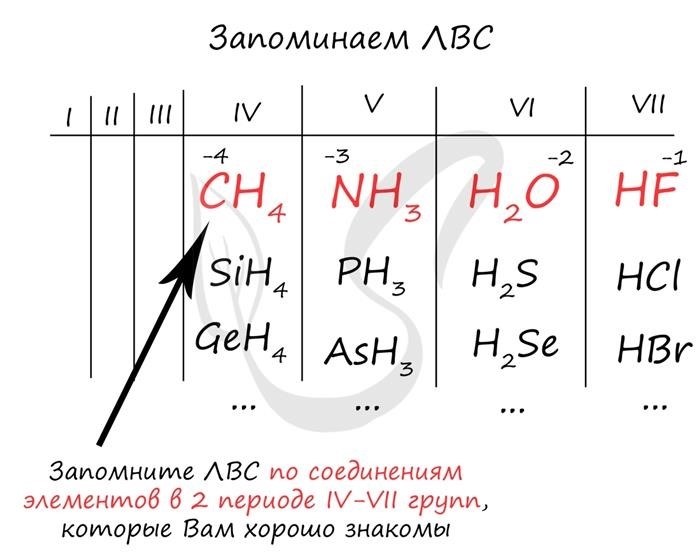
Электроотрицательность элементов
Электроотрицательность элемента определяет его способность притягивать электроны во время химических реакций. Электроотрицательность обычно возрастает по мере приближения к верхнему правому углу таблицы. Это связано с увеличением электронных оболочек и сильнее притяжением ядра к электронам. Величина электроотрицательности может также влиять на химическую активность элементов.
Реакционная способность элементов
Реакционная способность элементов зависит от их электронной конфигурации и наличия свободных валентных электронов. Обычно элементы с полностью заполненными электронными оболочками (нобелевы газы) обладают слабой реакционной способностью, так как у них нет свободных валентных электронов для образования связей с другими элементами. Элементы с неполностью заполненными электронными оболочками (например, алкалийные металлы) имеют большую реакционную способность и легко образуют химические соединения.
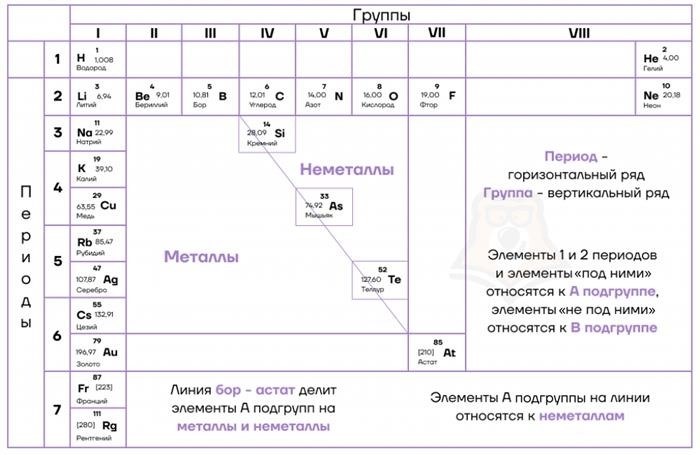
Таблица Менделеева
| Период | Группа | Химические свойства |
| 1 | 1 | Алкалии, высокая реакционная способность |
| 2 | 2 | Землеалкалии, валентность +2 |
| 3-12 | 3-12 | Переходные металлы, разнообразные валентности |
| 17 | 17 | Галогены, высокая электроотрицательность |
| 18 | 18 | Нобелевы газы, слабая реакционная способность |
Таким образом, закономерности изменения химических свойств элементов определяются их валентностью, радиусом атомов, электроотрицательностью и реакционной способностью. Эти закономерности отражаются в строении и расположении элементов в периодической системе.
Что мы узнали?
В этой статье мы исследовали тему периодического закона и периодической системы. Мы начали с понятия атома, изучили его строение и узнали о субатомных частицах, таких как протоны, нейтроны и электроны. Также мы обратили внимание на атомные номера и атомные массы элементов, которые позволяют нам классифицировать их в периодической системе.

Мы изучили структуру периодической системы, которая упорядочивает элементы на основе их атомных номеров и значений электронной конфигурации. Мы обратили внимание на периоды и группы элементов, а также на металлы, неметаллы и полуметаллы. Также мы узнали о связи между расположением элементов в периодической системе и их химическими свойствами.
Возможно, одно из самых важных открытий, которое мы сделали, это то, что периодическая система химических элементов позволяет нам предсказывать и объяснять химические свойства элементов на основе их расположения в таблице. Это даёт нам ценный инструмент для изучения и понимания широкого спектра явлений и процессов в химии.
Вот основные мысли, которые мы озвучили в данной статье:
- Атом состоит из протонов, нейтронов и электронов.
- Периодическая система классифицирует элементы на основе их атомных номеров и электронной конфигурации.
- Расположение элементов в периодической системе связано с их химическими свойствами.
- Периодическая система является важным инструментом для изучения и объяснения химических явлений и процессов.
Итак, мы посетили наше путешествие через периодический закон и периодическую систему, и надеюсь, что теперь вы лучше понимаете принципы и значимость этой области химии.