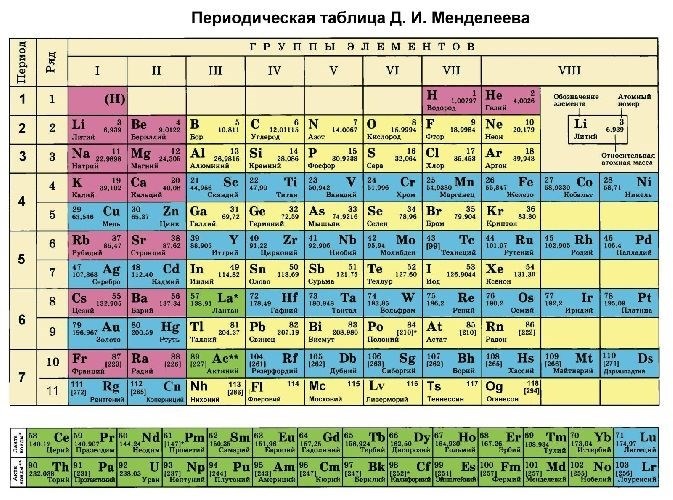
Периодическая система химических элементов Менделеева – это систематическое представление всех известных химических элементов, упорядоченных по возрастанию атомного номера и структуре атома. Она позволяет классифицировать элементы на основе их химических и физических свойств и предсказывать их взаимодействия с другими веществами. Периодическая система является основополагающим инструментом химии и имеет широкое применение в науке, технологии и промышленности.
Значение Периодической системы химических элементов для мировой науки
Основные принципы и составление Периодической системы
Периодическая система химических элементов основывается на принципе упорядочивания элементов по возрастанию их атомных номеров и наличии общей структуры. Данная система представляет собой таблицу, в которой элементы расположены по периодам и группам, в соответствии с их химическими свойствами и электронной конфигурацией. Составляя таблицу, Менделеев учел закономерности в химических свойствах элементов и предсказал свойства отсутствующих на тот момент элементов, что подтвердилось позднее.
Значение Периодической системы для развития науки
- Универсальность: Периодическая система химических элементов является универсальным инструментом для описания и предсказания химических свойств всех известных элементов и их соединений.
- Уяснение структуры вещества: Периодическая система позволяет лучше понять структуру и организацию вещества на молекулярном и атомном уровнях. Она помогает объяснить множество физических и химических явлений.
- Предсказание свойств элементов: Периодическая система позволяет предсказывать свойства новых элементов, которые были открыты или синтезированы позднее. Это позволяет исследователям оценить потенциальное применение данных элементов и разрабатывать новые материалы с заданными свойствами.
- Развитие новых отраслей науки: Периодическая система является основой многих научных дисциплин, таких как физика, химия, биология, материаловедение и др. Она стимулировала развитие новых областей науки и проведение множества исследований.
Примеры практического применения Периодической системы
Периодическая система химических элементов нашла широкое практическое применение в различных областях:
- Синтез новых материалов: Благодаря системе ученые могут выбирать элементы для синтеза новых материалов с определенными свойствами, такими как проводимость электричества, прочность, теплопроводность и т. д.
- Разработка лекарств и химических соединений: Периодическая система помогает разработать новые лекарственные и химические соединения, путем анализа истории и свойств элементов и их взаимодействия.
- Исследование каталитических процессов: Каталитические процессы играют важную роль в промышленности. Периодическая система помогает ученым разработать и усовершенствовать катализаторы для различных процессов.
- Разработка электроники и полупроводников: Периодическая система позволяет исследовать и выбирать элементы для создания новых материалов и компонентов в электронике и полупроводниковой промышленности.
Периодическая система химических элементов является неотъемлемой частью мировой науки. Она служит фундаментом для понимания и исследования мира элементов и их взаимодействий. Значение этой системы распространяется на множество областей науки и технологий, в том числе синтеза новых материалов, разработки лекарств и полупроводников, а также исследования каталитических процессов. Периодическая система Менделеева остается актуальной и важной в современной науке.

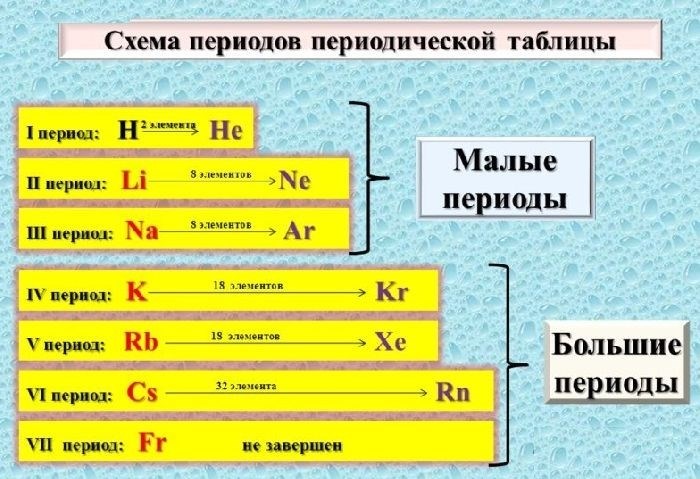
Формулировка периодического закона химических элементов
Основная и наиболее известная формулировка периодического закона химических элементов состоит из следующих положений:
1. Периодическая система химических элементов
- Химические элементы располагаются в порядке возрастания их атомных номеров.
- Элементы, расположенные в одной горизонтали (периоды), имеют одинаковое количество электронных оболочек.
- Элементы, расположенные в одном столбце (группы), имеют одинаковое количество электронов на внешней электронной оболочке и, следовательно, обладают схожими свойствами.
- Периодическая система состоит из 7 периодов и нескольких дополнительных групп.
2. Периодический закон
Периодический закон утверждает, что свойства химических элементов периодически повторяются с определенным интервалом. Это означает, что элементы, расположенные в одной группе, имеют аналогичные свойства и реактивность. Один из основных факторов, определяющих периодические закономерности, является количество электронов во внешней электронной оболочке.
3. Разделение элементов на блоки
В настоящее время распространена более подробная формулировка периодического закона, включающая разделение элементов на блоки:
- s-блок: элементы с заполненными или частично заполненными s-подуровнями электронов.
- p-блок: элементы с заполненными или частично заполненными p-подуровнями электронов.
- d-блок: элементы с заполненными или частично заполненными d-подуровнями электронов.
- f-блок: элементы с заполненными или частично заполненными f-подуровнями электронов.
4. Правило восходящего заполнения
Описывая периодический закон, важно упомянуть также правило восходящего заполнения, согласно которому электроны заполняют подуровни в порядке возрастания их энергии.
Формулировка периодического закона химических элементов является ключевым инструментом для понимания организации и свойств элементов в периодической системе Менделеева. Этот закон помогает химикам классифицировать и изучать свойства химических элементов, а также прогнозировать их взаимодействия и реактивность, что имеет большое значение во многих областях науки и промышленности.
История открытия периодического закона Менделеевым
Периодический закон был открыт русским химиком Дмитрием Менделеевым в 1869 году. Он представил новый подход к классификации элементов и предсказал существование ряда новых еще не открытых элементов.
Предыдущие модели классификации элементов
- Антуан Лавуазье – основоположник химии, предложил систему классификации на основе основных элементарных веществ.
- Джон Далтон – разработал теорию атомов, но его классификация элементов была неудобной и сложной.
- Жан-Батист Дюшан – попытался создать систему классификации на основе сходства химических свойств элементов.
Открытие Менделеева
Менделеев разработал новую систему классификации элементов, основанную на их атомном весе и химических свойствах. Он составил таблицу, в которой элементы были упорядочены по возрастанию их атомного веса.
| Элемент | Атомный вес |
|---|---|
| Водород | 1.0079 |
| Гелий | 4.0026 |
| Литий | 6.941 |
| … | … |
Периодический закон
Менделеев установил закономерность в химическом поведении элементов в таблице. Он заметил, что элементы с схожими химическими свойствами имеют похожие атомные веса и размещены в одном столбце. Эти столбцы он назвал группами, а строки – периодами.
“Периодический закон химии выражается в том, что свойства элементов круглой таблицы периодически изменяются с возрастанием их атомного веса.”
Предсказание новых элементов
Раскладывая элементы в таблице, Менделеев обнаружил незаполненные места и предсказал существование новых элементов, которые позже были открыты. Он описал их свойства, химические реакции и даже предупредил о том, что может существовать элемент, нарушающий закономерность.
“Если в будущем будут открыты элементы с атомными весами, близкими к весам, оставленным здесь пустыми, они будут обладать свойствами, хорошо согласующимися с этими прогнозами.”
Открытие периодического закона Менделеевым стало важным шагом для развития химии и помогло систематизировать знания о химических элементах. Современная периодическая система химических элементов, основанная на работе Менделеева, продолжает служить основой для изучения химии в наше время.
Популярные вопросы и ответы
1. Каково происхождение Периодической системы химических элементов Менделеева?
Периодическая система была разработана русским химиком Дмитрием Ивановичем Менделеевым в 1869 году. Он расположил элементы в порядке возрастания их атомных номеров и группировал их по сходству химических свойств. Таким образом, Менделеев создал универсальную систему классификации химических элементов.
2. Какие элементы входят в Периодическую систему Менделеева?
Периодическая система Менделеева включает в себя все известные химические элементы – от водорода (H) до унуноктия (Uuo). Всего в системе насчитывается 118 элементов. Каждый элемент имеет свой уникальный символ и атомный номер.
3. Какие основные группы элементов выделяются в Периодической системе Менделеева?
Периодическая система Менделеева делится на несколько групп элементов:
- Группа щелочных металлов (Li, Na, K, Rb, Cs, Fr)
- Группа щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra)
- Группа переходных металлов (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn и другие)
- Группа борных металлов (Al, Ga, In, Tl)
- Группа карбонильных элементов (C, Si, Ge, Sn, Pb)
- Группа азотосодержащих элементов (N, P, As, Sb, Bi)
- Группа редкоземельных элементов (La, Ce, Pr, Nd, Pm и другие)
- Группа инертных газов (He, Ne, Ar, Kr, Xe, Rn)
4. Для чего используется Периодическая система Менделеева?
Периодическая система Менделеева является удобным инструментом для изучения химических элементов и их свойств. Она позволяет устанавливать связи между элементами, предсказывать их реакционную способность, а также использовать в различных областях, включая химическую промышленность, медицину, энергетику и другие.
5. Как устроена Периодическая система Менделеева?
Периодическая система Менделеева устроена в виде таблицы, где элементы расположены в порядке возрастания их атомных номеров и атомных масс. Каждый элемент имеет свой уникальный символ, атомный номер и атомную массу. Таблица также отображает группы и периоды элементов, а также их химические свойства.
| Период | Группа | Элементы |
|---|---|---|
| 1 | 1 | Н |
| 2 | 2 | He |
| 2 | 13 | Li, Be, B, C, N, O, F, Ne |
| 3 | 14 | Na, Mg, Al, Si, P, S, Cl, Ar |
| 4 | 15 | K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br, Kr |
6. Можно ли предсказать химические свойства элемента по его расположению в Периодической системе?
Да, по расположению элемента в Периодической системе Менделеева можно сделать предположение о его химических свойствах. Близкие по своим химическим свойствам элементы расположены в одной вертикальной группе. Поэтому элементы одной группы имеют схожие реакции и образуют аналогичные соединения.

7. Какая роль играют периоды в Периодической системе Менделеева?
Периоды в Периодической системе Менделеева указывают на количество энергетических уровней, занятых электронами в атоме элемента. Чем выше период, тем больше энергетических уровней имеет элемент и тем больше электронов он содержит.
8. Кто продолжает развитие Периодической системы Менделеева сегодня?
Сегодня развитием Периодической системы Менделеева занимаются ученые и исследователи в области химии и физики. Они работают над открытием новых элементов, изучают их свойства и расширяют знания о химической классификации элементов.
Периодическая таблица Менделеева: основные принципы и структура
Основные принципы периодической таблицы Менделеева:
- Атомный номер: каждый элемент обозначается своим уникальным атомным номером, который указывает на количество протонов в атоме данного элемента.
- Атомная масса: элементы в таблице располагаются по возрастанию атомной массы. Атомная масса указывает на сумму протонов и нейтронов в атоме.
- Периоды: периоды – это строки таблицы, которые показывают количество электронных оболочек у элементов. Периоды обозначаются числами от 1 до 7.
- Группы: группы – это столбцы таблицы, которые обозначаются числами от 1 до 18. Есть несколько типов групп: соседние элементы в одной группе обладают похожими свойствами.
Структура периодической таблицы Менделеева:
В таблице Менделеева элементы обычно располагаются в 18 вертикальных колонках, но также применяются и другие форматы таблицы. Основная структура включает в себя следующие элементы:
| Группа | Химический символ | Имя элемента | Атомная масса | Атомный номер |
|---|---|---|---|---|
| 1 | H | Водород | 1,008 | 1 |
| 2 | He | Гелий | 4,0026 | 2 |
| … | … | … | … | … |
Значение и применение таблицы Менделеева:
Периодическая таблица Менделеева является основой для изучения химии, и она имеет большое значение в научных и практических приложениях. Ниже представлены некоторые из них:
- Описание и классификация химических элементов.
- Определение свойств элементов и их взаимодействие.
- Прогнозирование химических реакций и формирование химических соединений.
- Помощь в разработке новых материалов и соединений.
- Определение электронной конфигурации и качественных характеристик элементов.
Периодическая таблица Менделеева является важным инструментом для понимания химической структуры и свойств элементов. Она позволяет ученым и исследователям систематизировать и анализировать данные о химических элементах, что способствует развитию науки и технологий во многих областях.
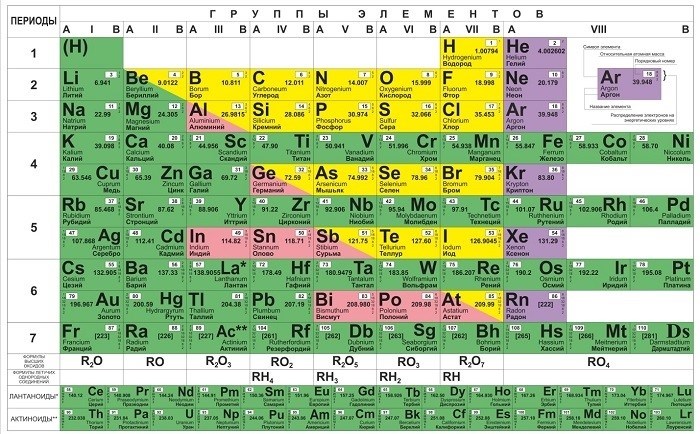
Как читать таблицу Дмитрия Ивановича Менделеева
Основные элементы таблицы:
- Группы: элементы, расположенные вертикально в таблице, имеют схожие свойства и одинаковое количество электронных оболочек.
- Периоды: элементы, расположенные горизонтально в таблице, имеют разное количество электронных оболочек и свойства изменяются по периодам.
- Блоки: элементы таблицы Менделеева разделены на блоки в зависимости от типа последнего занятого электронного подуровня.
Структура элемента в таблице Менделеева:
- Символ элемента: обозначение элемента, например, H для водорода.
- Атомный номер: число, указывающее на порядковый номер элемента в таблице.
- Относительная атомная масса: средняя масса атомов данного элемента.
Получение информации из таблицы:
Каждый элемент таблицы Менделеева содержит множество данных, которые могут быть полезными для химических расчетов и изучения свойств веществ:
| Свойство | Описание |
|---|---|
| Атомный радиус | Расстояние от центрального ядра элемента до его наружных электронов. |
| Электроотрицательность | Способность элемента притягивать электроны при образовании химических связей. |
| Период | Горизонтальное расположение в таблице Менделеева, указывающее на общее количество электронных оболочек. |
| Группа | Вертикальное расположение в таблице Менделеева, указывающее на количество электронов на последней энергетической оболочке. |
Важно знать, что таблица Менделеева постоянно обновляется, и в нее могут быть внесены изменения или добавлены новые элементы по мере исследований.
Что мы узнали?
В этой статье мы рассмотрели основные концепции и признаки периодической системы химических элементов Менделеева. Периодическая система представляет собой удобный и упорядоченный способ классификации элементов и позволяет нам лучше понять их химические свойства и закономерности.
Мы увидели, что периодическая система состоит из периодов и групп, и что каждый элемент имеет свой уникальный атомный номер, символ и относительную атомную массу. Мы узнали, что элементы в одной группе имеют схожие химические свойства, а элементы в одном периоде имеют последовательно возрастающие атомные номера.
Также мы изучили основные группы элементов, такие как щелочные металлы, щелочноземельные металлы, галогены и инертные газы. Мы увидели, что эти группы характеризуются определенными химическими свойствами и часто имеют похожие реакции и взаимодействия с другими веществами.
Таким образом, благодаря периодической системе химических элементов Менделеева мы можем систематизировать и упорядочить знания о химических элементах и лучше понять их свойства. Это помогает нам в научных и практических исследованиях, разработке новых материалов и лекарств, а также в повседневной химической практике.