Давление газа зависит от нескольких факторов: температуры, объема и количества газа. При увеличении температуры газа молекулы начинают двигаться быстрее, что приводит к увеличению их силы удара о стенки сосуда. Увеличение объема газа также приводит к увеличению давления, так как молекулы имеют больше места для движения. Количество газа оказывает прямую зависимость с давлением – чем больше газа, тем выше давление.
Зависимость давления от других величин
Давление газа зависит от нескольких величин, включая:
- Температуру
- Объем
- Количество вещества
Температура
Температура – один из основных факторов, влияющих на давление газа. При повышении температуры, молекулы газа приобретают большую энергию и начинают двигаться быстрее. Это приводит к увеличению силы, с которой молекулы сталкиваются с поверхностью и стенками сосуда, где находится газ. Поэтому при повышении температуры, давление газа увеличивается.
Объем
Объем – еще одна величина, влияющая на давление газа. При увеличении объема сосуда, в котором находится газ, количество молекул остается неизменным, а площадь, на которую молекулы могут столкнуться, увеличивается. Количество столкновений молекул с поверхностью и стенками сосуда уменьшается, что приводит к уменьшению давления газа.
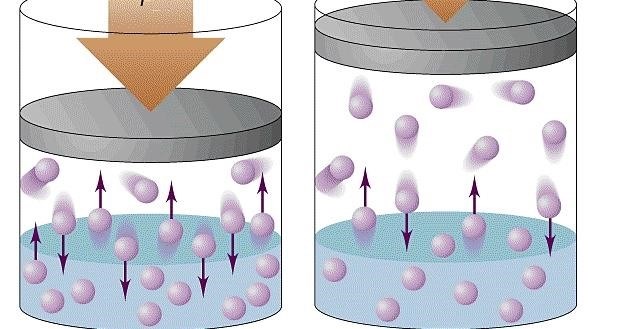
Количество вещества
Количество вещества – третий фактор, влияющий на давление газа. При увеличении количества вещества, количество молекул газа увеличивается, что приводит к увеличению площади, на которую молекулы могут столкнуться. Это приводит к увеличению количества столкновений молекул и, следовательно, к повышению давления газа.
Второй способ записи основного уравнения МКТ
Уравнение состояния газа
Уравнение состояния газа описывает соотношение между давлением, объемом и температурой газа. Оно является одним из основных уравнений в физике газов и записывается следующим образом:
PV = nRT
- P – давление газа
- V – объем газа
- n – количество вещества газа
- R – универсальная газовая постоянная
- T – температура газа
Преобразование уравнения
Для удобства расчетов, уравнение состояния газа можно преобразовать и записать в другой форме:
P = (n/V)RT
- P – давление газа
- n/V – концентрация газа (количество вещества, поделенное на объем)
- R – универсальная газовая постоянная
- T – температура газа
Такая запись уравнения позволяет более наглядно представить зависимость давления газа от его концентрации, температуры и универсальной газовой постоянной.
Второй способ записи основного уравнения МКТ позволяет описать зависимость между давлением, объемом и температурой газа более наглядно и удобно для расчетов. Это уравнение состояния газа является одним из ключевых в физике газов и широко применяется в различных областях науки и техники.
Как функционирует давление газа
Молекулярная теория
Для понимания давления газа нужно обратиться к молекулярной теории. Газ состоит из огромного количества молекул, которые непрерывно движутся в разных направлениях. При этом они сталкиваются со стенками контейнера, что создает силу, которую мы называем давлением.
Факторы, влияющие на давление газа
Давление газа зависит от нескольких факторов:
- Количество газа: Чем больше молекул газа в контейнере, тем больше сила столкновений и, соответственно, давление.
- Объем контейнера: Чем меньше объем контейнера, тем больше молекул на единицу площади стены и тем больше давление.
- Температура: При повышении температуры молекулы газа движутся быстрее и сталкиваются со стенами контейнера с большей силой, что увеличивает давление.
Закон Бойля-Мариотта
Закон Бойля-Мариотта описывает зависимость между объемом и давлением газа при постоянной температуре. Он утверждает, что при увеличении давления молекулы газа будут ближе к друг другу, что приведет к уменьшению объема контейнера.
“При постоянной температуре объем газа обратно пропорционален его давлению”
| Давление | Объем |
| Увеличивается | Уменьшается |
| Уменьшается | Увеличивается |
Понимание того, как функционирует давление газа, помогает нам контролировать и использовать его в различных сферах жизни. Знание молекулярной теории и факторов, влияющих на давление, позволяет нам предсказывать и измерять давление газа для достижения желаемых результатов.
Газ: агрегатное состояние
Основные характеристики газа:

- Восприимчивость к сжатию: газы могут легко сжиматься под действием давления, что позволяет им занимать большие объемы. В отличие от твердых и жидких веществ, газы не имеют определенной формы и объема.
- Расширение: газы могут расширяться при нагревании и сжиматься при охлаждении. Этот процесс называется термическим расширением газов.
- Диффузия: газы способны перемещаться и смешиваться между собой благодаря случайным тепловым движениям и их молекулярной структуре.
- Высокая подвижность: газы обладают высокой подвижностью, так как их молекулы движутся со сравнительно большой скоростью.
- Давление: газы оказывают давление на стенки сосудов, в которых они находятся. Давление газа зависит от его объема, количества молекул и их скорости.
| Газы | Жидкости | Твердые вещества | |
|---|---|---|---|
| Форма | Не имеют определенной формы | Имеют определенную форму | Имеют определенную форму |
| Объем | Могут занимать любой объем | Занимают определенный объем | Занимают определенный объем |
| Сжатие | Могут быть сжаты под давлением | Могут быть слегка сжаты | Практически неподвижны |
| Диффузия | Могут диффундировать и смешиваться | Могут диффундировать и смешиваться | Не диффундируют и не смешиваются |
“Газ – это агрегатное состояние вещества, которое обладает своими уникальными свойствами. Они могут быть сжаты, расширяться при нагревании и перемещаться с большой подвижностью. Давление газа зависит от его объема, количества молекул и их скорости. Такие особенности газов делают их важными для различных процессов в природе и промышленности.”
Причина возникновения давления в газах
Давление в газах обусловлено молекулярным движением частиц, которое происходит внутри газовой среды. Это движение вызывает столкновение молекул друг с другом и с поверхностью, что приводит к появлению давления.
Существует несколько ключевых факторов, влияющих на возникновение давления в газах:
1. Количество и скорость молекул
Давление в газе зависит от количества и скорости молекул. Чем больше частиц и чем быстрее они двигаются, тем выше будет давление. Увеличение количества молекул или их скорости приводит к повышению давления.
2. Объем газовой среды
Изменение объема газовой среды также влияет на давление. Если объем увеличивается при неизменной температуре и количестве молекул, давление уменьшается. Если же объем уменьшается, давление возрастает.
3. Температура газа
Температура является важным фактором, определяющим давление в газе. При повышении температуры молекулы обладают большей энергией, двигаются быстрее и сталкиваются с большей силой, что приводит к увеличению давления.
4. Масса молекул
Масса молекул также влияет на давление в газе. Чем больше масса молекул, тем выше будет давление. Об этом свидетельствует закон Дальтона – сумма давлений каждого компонента смеси газов равна общему давлению этой смеси.
5. Притяжение молекул
Притяжение молекул друг к другу, называемое силами взаимной притяжения, также влияет на давление в газе. Если силы притяжения больше, молекулы находятся ближе друг к другу и давление увеличивается.
| Фактор | Влияние на давление |
|---|---|
| Количество и скорость молекул | Увеличение приводит к повышению давления |
| Объем газовой среды | Увеличение объема приводит к уменьшению давления, уменьшение объема – к возрастанию |
| Температура газа | Повышение температуры приводит к повышению давления |
| Масса молекул | Увеличение массы приводит к повышению давления |
| Притяжение молекул | Увеличение притяжения приводит к повышению давления |
“Давление в газах обусловлено молекулярным движением частиц, при котором молекулы сталкиваются друг с другом и с поверхностью, создавая силу, действующую на единицу площади”.
– Физический учебник
Определение давления газа
Физическое определение
Давление газа можно определить как силу, действующую на единицу площади поверхности. Оно является количественной мерой столкновений и ударов молекул газа о поверхность.
Меры давления
- Бар – метрическая единица давления, равная 100 000 Па.
- Паскаль – единица измерения давления в системе Международной системы единиц (СИ). Один паскаль равен силе одного ньютона, действующей на площадь одного квадратного метра.
- Атмосфера – единица измерения давления, равная среднему атмосферному давлению на уровне моря.
Факторы, влияющие на давление газа
- Количество газа – при увеличении количества газа давление также увеличивается.
- Температура – при повышении температуры газа, его молекулы двигаются быстрее и сталкиваются с поверхностью с большей силой, что приводит к увеличению давления.
- Объем – при уменьшении объема газа, его молекулы оказываются ближе друг к другу и сталкиваются с поверхностью с большей силой, что приводит к увеличению давления.
Закон Бойля-Мариотта
Закон Бойля-Мариотта устанавливает, что при постоянной температуре количество газа обратно пропорционально его давлению. То есть, если увеличить давление на газ, его объем уменьшится, и наоборот.
Давление газа – важная физическая величина, определяемая столкновениями молекул газа с поверхностью. Оно зависит от количества газа, температуры и объема. Изучение давления газа позволяет понять его свойства и взаимодействие с окружающей средой.
Хранение и транспортировка газов
Хранение газов
Хранение газов требует особого внимания к безопасности. Для этого используются специальные резервуары, цистерны и контейнеры, которые соответствуют нормативам и требованиям безопасности. Газы могут быть хранены в различных формах: сжатые газы хранят в цилиндрах под высоким давлением, жидкие газы – в специальных контейнерах при низких температурах, а газы средней плотности – в резервуарах под небольшим давлением.
Правильное хранение газов требует соблюдения следующих условий:
- Хранение в специальных контейнерах и резервуарах, отвечающих нормам безопасности;
- Поддержание правильных температур и давления для каждого вида газа;
- Установка системы контроля и автоматического отключения в случае возникновения аварийных ситуаций;
- Правильное обозначение и маркировка газовых контейнеров;
- Соблюдение инструкций по безопасному обращению с газами.
Транспортировка газов
Транспортировка газов осуществляется различными способами в зависимости от их состояния и характеристик. Наиболее распространенными методами являются трубопроводный транспорт, транспортировка газа железной дорогой и автотранспортом.
Трубопроводный транспорт газа является наиболее экономически эффективным и безопасным способом доставки больших объемов газа на длительные расстояния. Для этого используются специальные трубопроводы, которые соответствуют требованиям прочности, герметичности и безопасности.
Транспортировка газа железной дорогой и автотранспортом чаще используется для доставки небольших объемов газа на более короткие расстояния. В этом случае необходимо соблюдать правила безопасности и упаковывать газовые контейнеры или баллоны в соответствующую транспортную упаковку с учетом предупреждения остановок и потери газа.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Трубопроводный | Экономически эффективный, безопасный, позволяет доставлять большие объемы газа | Требует значительных инвестиций в строительство и поддержание трубопроводов, ограничен географическим положением |
| Железнодорожный | Позволяет доставлять газ на большие расстояния, гибкость в выборе маршрута | Ограниченные возможности по перевозке больших объемов газа, требуется специальное оборудование и разрешения |
| Автотранспортный | Гибкость в выборе маршрута, возможность доставки газа в удаленные или труднодоступные места | Ограниченные возможности по перевозке больших объемов газа, ограниченный срок годности газовых контейнеров |
Правильное хранение и транспортировка газов являются важными аспектами для обеспечения безопасности и эффективности работы с газовыми веществами. Соответствующие запасы и транспортные мероприятия должны быть внимательно запланированы и осуществляться в соответствии с принятыми нормами и правилами.
Использование давления газа для выполнения работы
1. Пневматические системы и механизмы
Давление газа может быть использовано для привода различных пневматических систем и механизмов. Примеры включают пневматические цилиндры, пневматические насосы и пневматические клапаны. При подаче газа под давлением, эти устройства могут создавать движение, выполнять механическую работу и контролировать поток газа в системе.
2. Газовые двигатели
Давление газа может быть использовано для привода газовых двигателей. Внутренний сгорания газовых двигателей работает на основе закона Бойля – чем больше давление газа в цилиндре двигателя, тем больше мощность может быть получена от сгорания газа. Давление газа обеспечивает движение поршня в цилиндре, что приводит к повороту коленчатого вала и созданию работы.
3. Различные газовые законы в устройствах
Давление газа играет важную роль во многих устройствах, работающих на основе различных газовых законов. Например, закон Бойля устанавливает, что при постоянной температуре объем газа обратно пропорционален его давлению. Это применяется в пневматических системах, таких как шины автомобилей, где изменение давления влияет на объем газа и, следовательно, на его плотность и свойства.
4. Использование давления газа в холодильных системах
Давление газа также используется в холодильных системах для создания охлаждения. В этих системах газ под давлением проходит через компрессор, где его давление повышается, а затем проходит через испаритель, где происходит снижение давления. При этом процессе газ извлекает тепло из окружающей среды, что приводит к охлаждению.
5. Использование давления газа в промышленных процессах
Давление газа широко используется в промышленных процессах. Например, в процессе газификации угля, давление газа используется для превращения угля в синтез-газ, который может использоваться в производстве различных химических продуктов. Давление газа также используется в нефтяной и газовой промышленности для транспортировки газа по трубопроводам и поддержания давления в скважинах.

Таким образом, давление газа имеет широкий спектр применений, от пневматических систем до промышленных процессов. Использование давления газа для выполнения работы играет важную роль во многих технологических процессах и устройствах.
Формула давления идеального газа из молекулярно-кинетической теории
В молекулярно-кинетической теории давление газа определяется как сила, обусловленная столкновениями молекул газа с поверхностью, деленная на площадь этой поверхности. Таким образом, давление можно выразить формулой:
P = F/A
где P – давление газа, F – сила, обусловленная столкновениями молекул газа, A – площадь поверхности.
Молекулярно-кинетическая теория также утверждает, что сила, обусловленная столкновениями молекул газа, пропорциональна числу столкновений молекул газа с единицей площади поверхности и средней кинетической энергии молекулы газа. Таким образом, формула для силы столкновений может быть записана как:
F = n * m * v * Δv / Δt
где F – сила столкновений, n – число молекул газа, m – масса молекулы газа, v – средняя скорость молекул газа, Δv – изменение скорости молекулы за время Δt.
Подставив формулу для силы столкновений в формулу для давления, получим окончательную формулу давления идеального газа из молекулярно-кинетической теории:
P = (n * m * v * Δv / Δt) / A
Итак, формула давления идеального газа из молекулярно-кинетической теории позволяет связать давление газа с числом молекул, их массой, средней скоростью и изменением скорости молекулы, а также с площадью поверхности, с которой происходят столкновения.
Эта формула является одним из основных результатов молекулярно-кинетической теории и позволяет объяснить многие явления, связанные с газами, такие как изменение давления при изменении температуры и объема. Она также позволяет предсказывать поведение идеального газа в различных условиях.