Химические реакции являются основной составляющей химических процессов, протекающих в природе и в лаборатории. Они основаны на закономерностях, которые определяют направление и скорость протекания реакции. В данной статье рассмотрим основные закономерности, включая законы сохранения вещества и энергии, закон действующих масс, принцип Ле-Шателье и другие. Понимание этих закономерностей позволит более глубоко изучить и оценить химические процессы и их приложения в различных областях науки и техники.
Закон действующих масс
Определение
Закон действующих масс утверждает, что скорость химической реакции пропорциональна произведению концентраций источников реагентов, возведённых в степень, равную их коэффициентам в сбалансированном уравнении реакции.
| Реакция | Уравнение | Закон действующих масс |
|---|---|---|
| Реакция разложения | A → B + C | r = k[A] |
| Реакция образования | B + C → A | r = k[B][C] |
Применение

Закон действующих масс широко применяется в химической кинетике для определения скорости реакции и изучения её механизма. На его основе можно предсказать, как изменится скорость реакции при изменении концентрации реагирующих веществ.
Особенности
- Закон действующих масс применим только при заданной температуре и концентрации реагентов.
- Скорость реакции может быть изменена путем изменения концентраций реагирующих веществ.
- Закон действующих масс не учитывает влияние других факторов, таких как температура, давление или катализаторы.
Примечание:
Закон действующих масс, предложенный Петром Ильичом Унгерсом в 1854 году, является одним из основных принципов химической кинетики и широко используется в химическом анализе и промышленности.
Закон множественных пропорций
Закон множественных пропорций был открыт Джоном Дальтоном в начале XIX века и подтвержден большим количеством экспериментальных данных. Он был одним из основных фундаментальных законов, легших в основу развития структурной химии.
Принцип работы закона множественных пропорций:
- Элементы образуют несколько соединений друг с другом.
- Массы одного элемента, соединяющиеся с фиксированным количеством другого элемента, образуют пропорцию, выраженную целыми числами.
- Переход от одного соединения к другому сопровождается изменением пропорций между элементами.
Примеры применения закона множественных пропорций:
- Образование воды, где масса кислорода, соединяющегося с фиксированным количеством водорода, равна 8 граммам, 16 граммам и т.д.
- Формирование оксида азота, где масса азота, соединяющегося с фиксированным количеством кислорода, равна 14 граммам, 28 граммам и т.д.
Важность закона множественных пропорций:
Закон множественных пропорций является одним из ключевых законов химии. Его открытие позволило дать объяснение многим химическим реакциям и определить стехиометрию химических соединений. Этот закон получил широкое применение в различных областях химии и стал основой для дальнейших исследований и открытий.
Закон Ле Шателье: основные принципы и применение в химических реакциях
Основные принципы закона Ле Шателье:
- Смещение равновесия
- Воздействие на химическую систему
- Достижение нового равновесия
- Противодействие изменениям
Закон Ле Шателье находит широкое применение в различных химических реакциях и процессах. Ниже приведены некоторые примеры его применения:
Применение закона Ле Шателье:
| Реакция | Применение закона Ле Шателье |
|---|---|
| Реакция образования газа | Изменение давления или объема газа может изменить равновесие в реакции |
| Реакция образования раствора | Изменение концентрации реагентов или продуктов может изменить равновесие в реакции |
| Реакция образования отложений | Изменение температуры реакции может изменить равновесие в реакции |
Применение закона Ле Шателье позволяет управлять и контролировать химические процессы, оптимизировать условия реакции и повышать выход продукции. Кроме того, закон Ле Шателье позволяет понять, какие факторы влияют на равновесие реакции и как изменить эти факторы для достижения желаемого результата.
Основные понятия и законы в термодинамике
Определение системы и окружения
Система – это часть физического пространства, которая изолирована от воздействия внешних факторов и имеет определенные свойства и характеристики.
Окружение – это всё, что находится вне системы и может взаимодействовать с ней.
Первый закон термодинамики (закон сохранения энергии)
Первый закон термодинамики утверждает, что энергия не создается и не уничтожается, она только преобразуется из одной формы в другую или передается из одной системы в другую. Математически он выражается следующим образом:

ΔE = Q – W
где ΔE – изменение внутренней энергии системы,
Q – количество теплоты, полученное или отданное системой,
W – работа, совершенная системой.
Второй закон термодинамики
Второй закон термодинамики формулирует принцип энтропии, который говорит о том, что в изолированной системе энтропия всегда стремится увеличиваться или оставаться постоянной. Более конкретные формулировки второго закона термодинамики:
- Нельзя преобразовать полностью теплоту в работу без выброса теплоты в окружающую среду.
- Нельзя достичь абсолютного нуля (нулевой температуры) путем конечного количества операций.
- При достижении абсолютного нуля энтропия системы будет равна нулю.
Третий закон термодинамики
Третий закон термодинамики утверждает, что при абсолютном нуле температуры (0 К) все системы имеют нулевую энтропию. Однако, достижение абсолютного нуля технически невозможно, но этот закон позволяет нам понять, как энтропия системы изменяется с изменением температуры.
Основные понятия и законы в термодинамике являются фундаментальными для понимания принципов протекания химических реакций. Первый закон термодинамики утверждает сохранение энергии, второй закон формулирует принцип энтропии, а третий закон говорит о свойствах систем при абсолютном нуле температуры.
Закон сохранения массы: основные положения и примеры в химических реакциях
Для лучшего понимания закона сохранения массы рассмотрим несколько примеров в химических реакциях:
Пример 1: Горение
При сгорании древесины, например, происходит химическая реакция между кислородом и углеродом, при которой образуется углекислый газ и вода. Сумма массы углерода и кислорода в реагентах будет равна сумме массы углекислого газа и воды в продуктах реакции.
Пример 2: Реакция взаимодействия кислоты и основания
При взаимодействии кислоты и основания образуются соль и вода. Например, реакция между соляной кислотой и гидроксидом натрия приводит к образованию соли натрия и воды. Масса соли и воды в продуктах реакции будет равна массе кислоты и основания в реагентах.
Пример 3: Реакция образования осадка
При реакции образования осадка происходит образование твердого вещества (осадка) из растворенных веществ. Например, при смешивании растворов сульфата меди(II) и раствора гидроксида натрия образуется осадок гидроксида меди(II). В данном случае, масса осадка будет равна сумме массы сульфата меди(II) и гидроксида натрия в реагентах.

Таким образом, закон сохранения массы является фундаментальным принципом химии, который подтверждается множеством экспериментов. Он позволяет предсказывать массу продуктов реакции и определять количество реагентов, необходимых для получения определенного количества продукта.
Закон пропорциональных объемов
Согласно этому закону, объемы реагирующих газов и образующихся в результате реакции газов стоят в простой численной пропорции, если все газы находятся в одинаковых условиях температуры и давления.
Суть закона
Основная идея закона пропорциональных объемов заключается в том, что объемы реагирующих газов и их газовых продуктов прямо пропорциональны коэффициентам стехиометрического уравнения реакции.
Формулировка закона
Закон пропорциональных объемов можно сформулировать следующим образом:
- Все газы находятся в одинаковых условиях температуры и давления.
- Объемы реагирующих газов и образующихся в результате реакции газов прямо пропорциональны коэффициентам стехиометрического уравнения реакции.
Примеры применения закона
Рассмотрим некоторые примеры, демонстрирующие применение закона пропорциональных объемов:
| Реакция | Уравнение реакции | Объем газов |
|---|---|---|
| Сгорание метана | CH4 + 2O2 → CO2 + 2H2O | 1 объем + 2 объема = 1 объем + 2 объема |
| Образование воды | 2H2 + O2 → 2H2O | 2 объема + 1 объем = 2 объема |
| Образование аммиака | N2 + 3H2 → 2NH3 | 1 объем + 3 объема = 2 объема |
Значимость закона пропорциональных объемов
Закон пропорциональных объемов имеет большое значение в химии, так как он позволяет определить соотношение между объемами реагирующих газов и объемами образующихся газов. Это позволяет проводить расчеты объемов веществ, участвующих в реакции, и предсказывать эффективность химических процессов.
Итоги
Таким образом, закон пропорциональных объемов устанавливает, что объемы реагирующих газов и образующихся газов при химической реакции стоят в простой численной пропорции, если все газы находятся в одинаковых условиях температуры и давления. Этот закон позволяет определить соотношение между объемами газов и проводить расчеты объемов веществ, участвующих в реакции.
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ ТЕРМОХИМИИ И ТЕРМОДИНАМИКИ
Термохимия
Термохимия изучает тепловые эффекты, происходящие во время химических реакций. Она основана на двух ключевых понятиях: теплоемкость и энтальпия.
- Теплоемкость – это количество теплоты, которое нужно передать или отнять от системы, чтобы изменить ее температуру на 1 градус Цельсия. Она измеряется в джоулях/градус Цельсия (Дж/°C).
- Энтальпия – это тепловое содержание системы. Она определяет разницу в энергии между исходными веществами и конечными продуктами реакции. Энтальпия измеряется в джоулях (Дж).
Основным законом термохимии является закон Гесса, который утверждает, что изменение энтальпии реакции не зависит от числа этапов, проведенных в ходе реакции. Этот закон позволяет суммировать энтальпии различных реакций, чтобы определить энтальпию реакции.
Термодинамика
Термодинамика изучает превращение энергии и ее связь с макроскопическими свойствами системы. Важными элементами термодинамики являются энергия, энтропия и свободная энергия.
- Энергия – это способность системы выполнять работу или передавать тепло. В термодинамике рассматривается внутренняя энергия системы, которая определяется суммой кинетической и потенциальной энергий ее частиц.
- Энтропия – это мера беспорядка системы. В термодинамике энтропия увеличивается при необратимых процессах и достигает максимального значения в состоянии термодинамического равновесия.
- Свободная энергия – это энергия, которая может быть использована для выполнения работы при постоянной температуре и давлении. Она является критерием спонтанности реакции.
Основным законом термодинамики является первый закон термодинамики, известный также как закон сохранения энергии. Он утверждает, что энергия не может быть создана или уничтожена, только превращена из одной формы в другую.
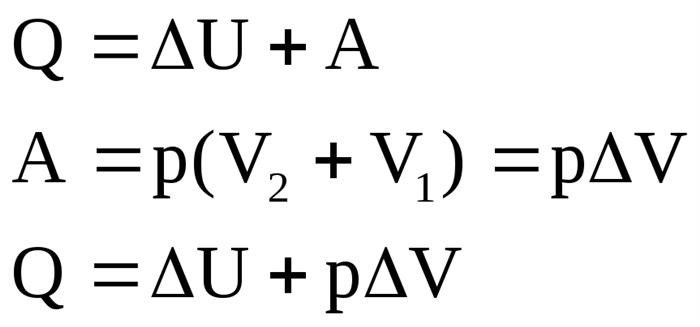
| Термохимия | Термодинамика |
|---|---|
| Изучает тепловые эффекты реакций | Изучает превращение энергии |
| Основные понятия: теплоемкость, энтальпия | Основные понятия: энергия, энтропия, свободная энергия |
| Закон Гесса | Первый закон термодинамики |
Термохимия и термодинамика являются важными областями химии, которые помогают понять энергетические свойства химических реакций. Они позволяют рассчитывать тепловые эффекты реакций и определять условия, при которых реакции протекают самопроизвольно.
Закон постоянства состава
Принцип действия закона постоянства состава:
- Реагенты, участвующие в химической реакции, претерпевают изменения и превращаются в продукты.
- Масса всех реагентов до реакции равна массе всех продуктов после реакции.
- Атомы каждого элемента в реагентах и продуктах сохраняются.
Исходя из закона постоянства состава, можно установить массовые соотношения между реагентами и продуктами с помощью стехиометрических расчетов.
Пример применения закона постоянства состава:
Рассмотрим реакцию сгорания метана (CH4) в кислороде (O2):
CH4 + 2O2 → CO2 + 2H2O
Согласно закону постоянства состава, масса метана (CH4), кислорода (O2), углекислого газа (CO2) и воды (H2O) будет сохраняться.
Таблица массовых соотношений реагентов и продуктов:
| Вещество | Масса в граммах |
|---|---|
| Метан (CH4) | 16 г |
| Кислород (O2) | 64 г |
| Углекислый газ (CO2) | 44 г |
| Вода (H2O) | 36 г |
Таким образом, согласно закону постоянства состава, массовые соотношения реагентов и продуктов в реакции горения метана будут соответствовать приведенным значениям.
«Закон постоянства состава является фундаментальным принципом химии, который позволяет предсказывать результаты химических реакций и проводить стехиометрические расчеты с высокой точностью».
Сравнительная таблица химических законов
Ниже приведена сравнительная таблица основных химических законов: