Количество вещества моль молярная масса – важные понятия в химии, которые позволяют выражать количество химических веществ в системе. Количество вещества измеряется в молях и определяется, исходя из числа частиц элементов или соединений. Молярная масса, в свою очередь, является массой одного моля вещества и используется для преобразования массы вещества в количество вещества. Наличие понимания этих понятий позволяет более точно описывать и анализировать химические реакции и взаимодействия.
Единица измерения количества вещества
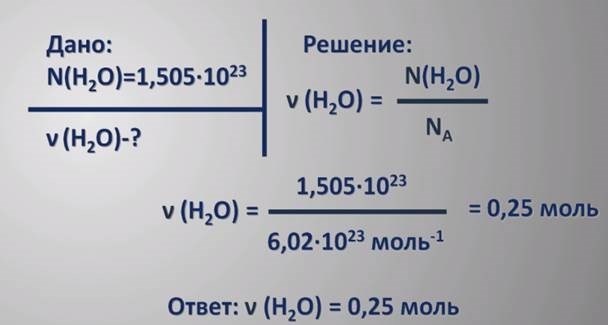
Формула расчета количества вещества
Количество вещества (в молях) можно вычислить по формуле:
n = m/M
где:

- n – количество вещества в молях;
- m – масса вещества в граммах;
- M – молярная масса вещества в г/моль.
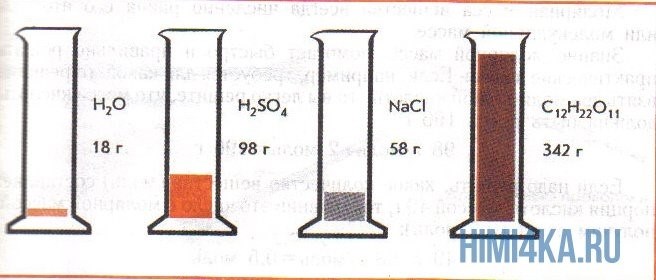
Пример использования единицы измерения количества вещества:
| Вещество | Масса (г) | Молярная масса (г/моль) | Количество вещества (моль) |
|---|---|---|---|
| Вода | 18 | 18 | 1 |
| Кислород | 32 | 32 | 1 |
| Углекислый газ | 44 | 44 | 1 |
Закон сохранения массы и количества вещества
В химических реакциях количество вещества сохраняется. Это значит, что количество вещества в реагентах должно быть равно количеству вещества в продуктах. Данный закон, известный как закон сохранения массы и количества вещества, был сформулирован Антуаном Лавуазье и является одним из основных законов химии.
Антуан Лавуазье:
“В химии, как и в любой другой науке, огромное значение имеют результаты количественных измерений”.
Относительная атомная и молекулярная массы
Перейдем теперь к относительной молекулярной массе. Она определяется как отношение массы молекулы вещества к одной двенадцатой массы атома углерода-12. Относительная молекулярная масса является безразмерной величиной и позволяет сравнивать массу молекул разных веществ между собой.
Расчет относительной атомной массы
- Определить количество атомов каждого элемента в молекуле вещества.
- Узнать атомные массы каждого элемента из периодической системы элементов.
- Умножить количество атомов каждого элемента на его атомную массу.
- Сложить полученные значения.
Пример расчета относительной атомной массы
| Элемент | Атомная масса | Количество атомов | Масса элемента |
|---|---|---|---|
| Натрий (Na) | 22.99 | 1 | 22.99 |
| Хлор (Cl) | 35.45 | 1 | 35.45 |
Относительная атомная масса NaCl = 22.99 + 35.45 = 58.44 а.е.м.
Расчет относительной молекулярной массы
- Определить количество атомов каждого элемента в молекуле вещества.
- Узнать атомные массы каждого элемента из периодической системы элементов.
- Умножить количество атомов каждого элемента на его атомную массу.
- Сложить полученные значения.
Пример расчета относительной молекулярной массы
| Элемент | Атомная масса | Количество атомов | Масса элемента |
|---|---|---|---|
| Водород (H) | 1.01 | 2 | 2.02 |
| Кислород (O) | 16.00 | 1 | 16.00 |
Относительная молекулярная масса H2O = 2.02 + 16.00 = 18.02
Относительная атомная и молекулярная массы используются для проведения различных химических расчетов и определения количества вещества в реакциях.
Определение, единицы измерения, обозначение
Количество вещества обозначается символом “n”. Оно можно определить как отношение массы вещества к его молярной массе.
Единицы измерения
Единицы измерения количества вещества:
- Моль (мол) – основная единица измерения количества вещества. Одна моль соответствует количеству вещества, содержащему в себе столько частиц (атомов, молекул и др.), сколько атомов содержится в 12 граммах углерода-12.
- Киломоль (кмол) – кратная единица измерения количества вещества, равная 1000 молям.
- Миллимоль (ммоль) – кратная единица измерения количества вещества, равная 0,001 молю.
Обозначение
Количество вещества обозначается символом “n”. Единицы измерения добавляются после обозначения количества вещества:
- Моль – “моль” или “мол”. Например, “n = 2 моль”.
- Киломоль – “киломоль” или “кмол”. Например, “n = 0,5 кмол”.
- Миллимоль – “миллимоль” или “ммоль”. Например, “n = 100 ммоль”.
Также можно использовать префиксы для обозначения кратных и долей единиц измерения количества вещества. Например, “n = 3 кмоль” или “n = 0,02 ммоль”.
Молярная масса вещества
Расчет молярной массы осуществляется путем суммирования атомных масс всех атомов, входящих в молекулу вещества. Для этого необходимо знать химическую формулу вещества и молекулярные массы его составных элементов. Молярная масса измеряется в г/моль и является высоко точной и надежной величиной.

Молярная масса влияет на свойства вещества и является одним из факторов, определяющих его поведение при химических реакциях. Например, при определении количества вещества или массы нужно знать молярную массу, чтобы провести расчеты с высокой точностью.
Таким образом, молярная масса вещества является важным понятием в химии и позволяет связать количество вещества и его массу. Это ключевой параметр для решения различных задач и проведения химических расчетов.
Все вопросы, относящиеся к расчетам с использованием молярной массы, требуют аккуратности и точности в получении значений. Ошибки или неточности в расчетах могут привести к неверным результатам и неправильным интерпретациям химических фактов и закономерностей.