Степень окисления является ключевым понятием в химии, позволяющим определить, какие ионы присутствуют в соединении и как они связаны между собой. Определение степени окисления является важной задачей при изучении реакций и взаимодействий веществ, поэтому знание методов ее определения является необходимым для всех, кто интересуется химией.
Вопросы для самопроверки
Ниже приведены несколько вопросов, которые помогут вам проверить свои знания степени окисления в соединениях. Ответьте на них самостоятельно и затем проверьте свои ответы.
1. Что такое степень окисления?
Ответ: Степень окисления – это числовое значение, которое отражает относительное количество электронов, перенесенных атомом в ходе окисления или восстановления. Она позволяет определить, сколько электронов получил или отдал атом в химической реакции.
2. Как определить степень окисления в неорганических соединениях?
Ответ: Для определения степени окисления в неорганических соединениях нужно знать правила определения степени окисления элементов. Некоторые основные правила:
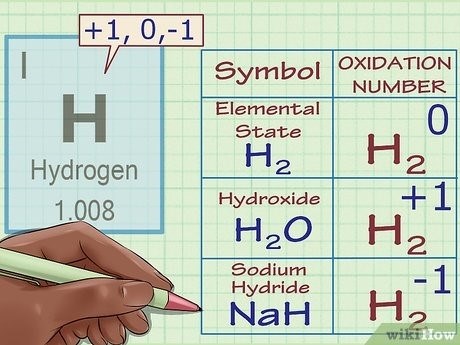
- Степень окисления элемента в элементарном состоянии равна нулю.
- Степень окисления кислорода во всех соединениях, кроме пероксидов, равна -2.
- Степень окисления водорода во всех соединениях, кроме металлов и гидридов, равна +1.
- Степень окисления металла в его ионе равна заряду иона.
3. Как определить степень окисления в органических соединениях?
Ответ: В органических соединениях степень окисления определяется по правилам определения степени окисления углерода. Некоторые основные правила:
- Степень окисления углерода в алканах равна нулю.
- Степень окисления углерода в алкенах равна -1.
- Степень окисления углерода в алканолах равна -2.
- Степень окисления углерода в карбоновых кислотах равна +2.
4. Каким образом степень окисления влияет на химические реакции?
Ответ: Степень окисления вещества определяет его реакционные свойства и возможность взаимодействия с другими веществами. Реакции окисления-восстановления, к примеру, основываются на изменении степени окисления элементов в ходе реакции. Отдельные ионы и атомы могут вступать в различные окислительные или восстановительные реакции в зависимости от их степени окисления.
5. Почему важно уметь определять степень окисления в соединениях?
Ответ: Определение степени окисления в соединениях позволяет понять, как элементы распределены в соединении и как они взаимодействуют друг с другом. Это важно для анализа химических реакций, составления уравнений и предсказания свойств соединений. Знание степени окисления также помогает в изучении электрохимических процессов и понимании основных принципов редокс-реакций.
Полезная информация о степени окисления
1. Стандартные оксиды и сколько электронов они принимают или отдают
Степень окисления атома в стандартных оксидах может быть определена на основе следующих правил:
- Алкалий и щелочноземельные металлы (группы 1 и 2) имеют степень окисления +1 и +2 соответственно.
- В стандартном оксиде кислорода (O2) степень окисления каждого атома кислорода составляет -2.
- В пероксидах (O2 2-) степень окисления атома кислорода составляет -1.
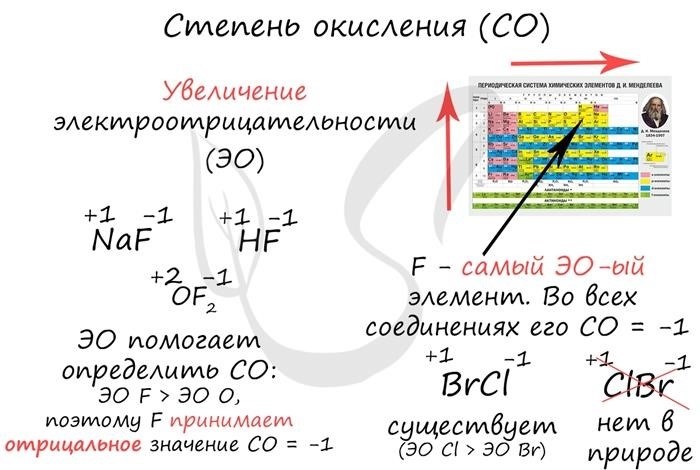
- Во фторидах (F -) степень окисления атома фтора составляет -1.
- Водород имеет степень окисления +1, за исключением металлических гидридов, где его степень окисления составляет -1.
2. Металлы с переменной степенью окисления
Некоторые металлы могут образовывать соединения с различными степенями окисления. Например, железо может иметь степень окисления +2 или +3 в различных соединениях. Чтобы определить степень окисления металла с переменной степенью окисления, необходимо учесть заряд самого соединения или других атомов и ионов в соединении.
3. Комплексы и степень окисления центрального иона
В комплексных соединениях, где центральный ион связан с лигандами, степень окисления центрального иона может быть определена, учитывая заряд каждого лиганда и общий заряд комплекса. Узнав степень окисления центрального иона, можно определить, какие элементы вступают в окислительно-восстановительные реакции и как изменяется степень окисления.
| Степень окисления | Значение |
|---|---|
| I | +1 |
| II | +2 |
| III | +3 |
| IV | +4 |
| V | +5 |
| VI | +6 |
| VII | +7 |
| VIII | +8 |
4. Значение степени окисления и химические реакции
Знание степени окисления помогает в понимании и анализе химических реакций. Изменение степени окисления указывает на процесс окисления или восстановления в реакции. Также можно определить окислитель, восстановитель и саму окислительно-восстановительную реакцию на основе изменения степени окисления атомов и ионов в реагентах и продуктах реакции.
Валентность и степень окисления: в чем разница?
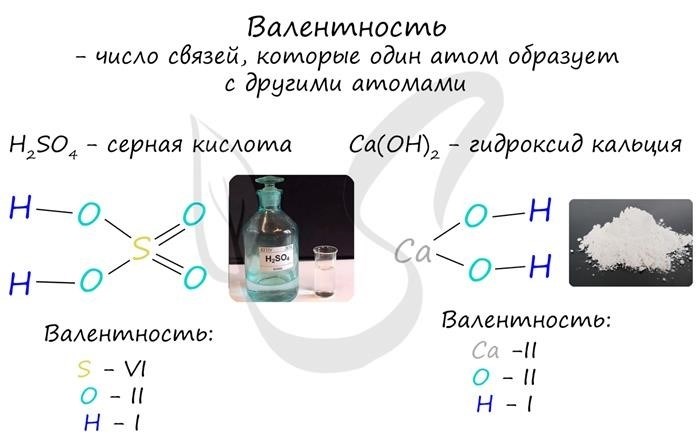
Валентность
Валентность – это количество валентных электронов, которые элемент или ион может отдать или принять при образовании химической связи. Валентность определяется номером группы элемента в таблице Менделеева. Например, у элемента из первой группы (алкалии) валентность равна 1, так как он способен отдать один электрон. Элемент из второй группы имеет валентность 2, так как он может отдать или принять два электрона и т.д.
Валентность является постоянной характеристикой элемента и не меняется в различных соединениях. Она помогает определить, какие элементы могут образовывать стабильные соединения и какие типы химических связей будут присутствовать.
Степень окисления
Степень окисления – это числовое значение, которое отражает относительное количество электронов, которые элемент потерял или приобрел при образовании соединения. Она позволяет оценить степень окисления элемента в конкретном соединении и определить его химическую активность.
Степень окисления может быть положительной, отрицательной или нулевой, в зависимости от того, потерял или приобрел ли элемент электроны. Например, у кислорода в воде (H2O) степень окисления равна -2, так как он получает два электрона от водорода. В то же время, у водорода степень окисления равна +1, так как он отдает один электрон.
| Элемент | Степень окисления |
|---|---|
| Кислород в H2O | -2 |
| Водород в H2O | +1 |
Степень окисления может изменяться в разных соединениях и зависит от конкретных условий реакции. Она является важным инструментом для анализа и предсказания химических реакций и свойств соединений.
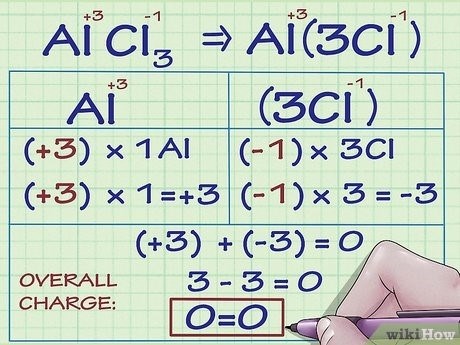
Таким образом, разница между валентностью и степенью окисления заключается в том, что валентность – это количество валентных электронов, которые атом элемента может отдать или принять, а степень окисления – это числовое значение, отражающее относительное количество электронов, которые элемент потерял или приобрел в соединении.
Алгоритм определения степени окисления по формуле
Шаг 1: Определение элементов в формуле соединения
Первым шагом в определении степени окисления является раскрытие формулы соединения и определение элементов, входящих в состав данного соединения.
Шаг 2: Определение окислителя и восстановителя
Для определения степени окисления каждого элемента в соединении, необходимо определить окислителя и восстановителя в данной реакции. Окислитель – это элемент, который подвергается окислению, т.е. теряет электроны, а восстановитель – это элемент, который подвергается восстановлению, т.е. получает электроны.
Шаг 3: Использование правил определения степени окисления
Для определения степени окисления каждого элемента существуют определенные правила. Некоторые из них:
- Степень окисления свободного элемента равна 0.
- Степень окисления одноатомного иона равна его заряду.
- Степень окисления кислорода в соединениях обычно равна -2, за исключением пероксидов (степень окисления кислорода в пероксидах равна -1).
- Степень окисления водорода в соединениях обычно равна +1, за исключением гидридов металлов (степень окисления водорода в гидридах металлов равна -1).
- Степень окисления щелочного металла в соединениях (например, Na, K) обычно равна +1.
Шаг 4: Решение уравнения степеней окисления
Используя полученные значения степеней окисления и зная, что сумма степеней окисления в химическом соединении должна быть равна нулю или заряду соединения, можно составить и решить уравнение степеней окисления. Результатом должны быть значения степеней окисления каждого элемента в соединении.
Пример
Для примера рассмотрим соединение H2O (вода) и определим степень окисления каждого элемента.

- Определение элементов: вода состоит из элементов водорода (H) и кислорода (O).
- Определение окислителя и восстановителя: в данном случае, водород подвергается окислению (теряет электроны), а кислород – восстановлению (получает электроны).
- Определение степени окисления: степень окисления водорода в воде равна +1, а степень окисления кислорода равна -2 (согласно правилам определения степени окисления).
- Решение уравнения степеней окисления: 2*(+1) + (-2) = 0. Значения степеней окисления соответствуют полученным ранее.
Таким образом, вода имеет степень окисления водорода +1 и степень окисления кислорода -2.
Популярные вопросы и ответы
В данной статье мы рассмотрели основные методы и принципы определения степени окисления в соединениях. Ниже приведены ответы на некоторые популярные вопросы, которые могут возникнуть при изучении данной темы.
-
Как определить степень окисления металла в бинарных соединениях?
Степень окисления металла в бинарных соединениях можно определить по его электроотрицательности. Если металл находится в положительной части периодической системы, то его степень окисления равна его заряду. Если металл находится в отрицательной части периодической системы, то его степень окисления равна разности между зарядом металла и суммарным зарядом остальных элементов.
-
Что такое степень окисления кислорода?
Степень окисления кислорода в большинстве соединений равна -2. Однако есть исключения, например, водород перекиси (H2O2), в которой степень окисления кислорода равна -1.
-
Как определить степень окисления элементов в сложных соединениях?
Для определения степени окисления элементов в сложных соединениях необходимо использовать правила окислительно-восстановительных реакций. Например, водород обычно имеет степень окисления +1, кислород -2, а простые металлы имеют степень окисления, равную их заряду. С использованием этих правил можно определить степень окисления элементов в сложных соединениях.
-
Может ли степень окисления элемента быть десятичным числом?
Все элементы в химических соединениях имеют целочисленные степени окисления. Десятичные числа могут возникать при расчетах или рассмотрении реакций с участием электронов, но в фактических соединениях степени окисления всегда являются целыми числами.
Итак, определение степени окисления в соединениях является важным шагом в изучении химии. Правильное определение степени окисления позволяет понять реакционные возможности вещества, его свойства и реакционную способность. Знание степени окисления может помочь в анализе химических реакций и предсказании их хода.